下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是地壳中含量最高的金属,K是一种红棕色气体,过量G与J溶液反应生成M。
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第_______周期第_______族。
(2)在反应⑦中还原剂与氧化剂的物质的量之比为___________________。
(3)简述M溶液中阳离子的检验方法 。
(4)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 。
(5)将化合物D与KNO3、KOH高温共熔,可制得一种“绿色”环保高效净水剂K2FeO4,同时还生成KNO2和H2O,该反应的化学方程式是_________________________。
(6)镁与金属I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg与金属I的单质在一定温度下熔炼获得。
①熔炼制备该合金时通入氩气的目的是 。
② I电池性能优越,I-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。
已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为________________________
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为___________________________
(4)已知下列几种试剂:
a.无水CuSO4 b.品红溶液 c.酸性KMnO4溶液
d.澄清石灰水 e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebd B.adeb C.abcbd D.abd
物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
(1)写出用惰性电极电解M溶液的离子方程式 。
(2)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是 。
(3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是 。
(4)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是 。
(5)若A是一种溶液,只可能含有 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为 。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为 。
A~H均为短周期元素,A~F在元素周期表中的相对位置如图1所示,G与其它七种元素
| 图1 |
|||
| A |
B |
C |
|
| D |
|
E |
F |
| 图2 |
|||
 |
不在同一周期,H是短周期中原子半径最大的主族元素。由B、G构成的最简单化合物常为氮肥工业和纯碱工业的原料。由上述某些元素组成的物质甲~戊的转化关系如图2所示。请回答下列问题:
(1)已知图2中反应①是复分解反应,生成物中水已略去。
a.若戊是含有18电子的双原子分子,则甲的电子式为:_________。实验室制取气体丙的化学方程式为:___________________________。
b.若甲的水溶液呈碱性,丙的凝胶经干燥脱水后,常用做干燥剂,写出甲的一种用途 。
c.若将a和b中甲的饱和溶液混合,会出现白色胶状沉淀,同时伴有刺激性气味的气体产生,则该反应的离子方程式: 。
(2)已知图2中反应①是置换反应,戊是单质,则戊可能是 或 ,分别写出一个对应的反应①的化学方程式 、 。
在下列物质转化关系中,反应的条件和部分产物已略去。
回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应。
①反应Ⅰ中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是________(填字母)。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是______________________________________。
③通过比较反应Ⅰ、Ⅱ的反应条件,可得出甲的金属性比乙的金属性________(填“强”或“弱”),比较二者金属性强弱的依据还可以是(写出一种即可)__________________。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应Ⅲ的化学方程式是__________________________________________________。
②反应Ⅰ的另一种产物为有机物,则该有机物的电子式是______________。
③在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。其反应的离子方程式是______________________________________________。
下图所涉及的物质均为中学化学中的常见物质,其中C为无色气体单质,D为有色气体单质,E为金属单质,其余为化合物。它们存在如下转化关系(反应中生成的水及次要产物均已略去)。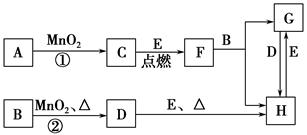
(1)写出有关物质的化学式:F________,H________。
(2)若反应①是在加热条件下进行,则A是________;若反应①是在常温条件下进行,则A是________。
(3)写出B与MnO2共热获得D的化学方程式______________________________。
(4)B的稀溶液与AgNO3溶液混合可形成沉淀AgX,已知Ksp(AgX)=1.8×10-10。将B的稀溶液与AgNO3溶液等体积混合,若B的浓度为2×10-4 mol·L-1,则生成沉淀所需AgNO3溶液的最小浓度为________mol·L-1。若向AgX悬浊液中滴加KI溶液,观察到的现象是______________________________,沉淀能够发生转化的原因是_________________________________________。
已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为________________________
_________________________________________________________________。
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为_________________________________________________________________。
(4)已知下列几种试剂:
a.无水CuSO4
b.品红溶液
c.酸性KMnO4溶液
d.澄清石灰水
e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebd B.adeb C.abcbd D.abd
在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,I为一常见金属,酸G是重要的化工产品和化工原料;固体H能够溶解在A溶液和酸G中,且H为良好的耐火材料(图中部分产物没有列出)。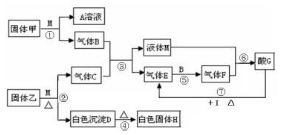
(1)固体甲与液体M反应的方程式为______。A溶液与固体H反应的离子方程式为______。
(2)固体乙的化学式为_______。液体M的电子式为_______。
(3)反应①~⑦中属于氧化还原反应的为_______(填写反应序号)。
(4)若I与C的稀溶液不反应,只能与G的浓溶液在加热条件下反应,则反应⑦的化学方程式为_______。
(5)若由黄铁矿(FeS2)与气体B反应来生产气体E,且每生成1 mol E放出426.5 kJ的热量,该反应的热化学方程式为_______ 。
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为 (用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法: 。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有 。
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。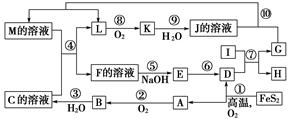
提示:4FeS2+11O2高温,2Fe2O3+8SO2
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第________周期________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为________。
(3)在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是________(填序号)。
(4)反应④的离子方程式是_____________________________________。
(5)将化合物D与KNO3、KOH共熔,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是________________________。
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
已知:
①单质中只有A为金属,在大气层高空释放的蒸气呈现明亮的橙黄色云雾,科学家由此可确定火箭在空中的位置;B、C、D为气体,E为固体;C、E为有色物质。
②B与D可以生成化合物J,A与J反应生成D和另一种化合物K,C与K反应的产物含漂白液的有效成分,F、G、I的水溶液呈碱性。
回答问题:
(1)化合物K的电子式为________。
(2)F的水溶液呈碱性的原因(用离子方程式表示)_________________________________,写出I与J反应的化学反应方程式__________________________________________。
(3)实验室制备C的离子反应方程式为_____________________________。
(4)D在C中燃烧观察到的现象是_________________________________。
(5)可利用B与D生成化合物J的反应制成燃料电池,若1 g D在B中燃烧生成气态J时,放出120.9 kJ的热量,已知1 mol J 在汽化时吸热44.0 kJ,写出表示D的燃烧热的热化学方程式_____________________________________________________,利用K作电解质溶液,写出该燃料电池的负极的电极反应方程式________________________。
A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,A—J的所有物质之间有如下的转化关系(部分反应产物省略): 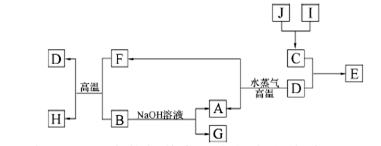
(1)B元素和C元素的简单离子半径大小关系是 (用离子符号表示):
(2)将氮元素与C形成的化合物NC3加入水中产生使红色石蕊试纸变蓝的气体,写出该反应的化学方程式 ;
(3)由E的饱和溶液滴入沸水中形成透明液体,再将此液体装入U型管,并在U型管的两端插入电极,接通直流电,在阳极端可观察到的现象是 ;
(4)将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是
;
(5)向含有0.1 mol G的溶液中滴加5 mol/L 的盐酸溶液,得到沉淀3.9 g ,则加入盐酸的体积可能为 。
Ⅰ.下列化合物中,含有非极性共价键的离子化合物是 ( )。
| A.CaC2 | B.N2H4 | C.Na2S2 | D.NH4NO3 |
Ⅱ.图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。
回答下列问题:
(1)图B对应的物质名称是________,其晶胞中的原子数为________,晶体类型为________。
(2)d中元素的原子核外电子排布式为________。
(3)图A中由二种元素组成的物质中,沸点最高的是________,原因是________________________________________________________________________,该物质的分子构型为________,中心原子的杂化轨道类型为________。
(4)图A中的双原子分子中,极性最大的分子是________。
(5)k的分子式为________,中心原子的杂化轨道类型为________,属于________分子(填“极性”或“非极性”)。
)已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为
_________________________________________________________________
________________________________________________________________。
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为________________________________________________________________。
(4)已知下列几种试剂:
a.无水CuSO4 b.品红溶液 c.酸性KMnO4溶液
d.澄清石灰水 e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebd B.adeb C.abcbd D.abd
(14分)X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式)
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系
其中C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式 ;D的电子式 。
①如果A、B均由三种元素组成,B为两性化合物,且不溶于水,则由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因 。
A、B浓度均为0.1mol/L等体积的混合溶液中,离子浓度由大到小的顺序为 。