X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示。
回答下列问题:
(1)A的电子式为 。
(2)A和E反应生成G,C与G中都含有 (填化学键的类型)。
(3)反应③中如果转移的电子为3 mol,则被氧化的A为 mol。
(4)科学家发明了使ZX3直接用于燃料电池的方法,其装置用铂作电极,加入碱性电解质溶液,往一极通入空气,另一电极通入ZX3并使之转化为无污染的气体,试写出负极的电极反应式: 。
(5)由Z、X两元素形成的含10个电子的阳离子可和XSO4-形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为: 。
在一定条件下,单质B、C、D、E都能与A单质发生化合反应,转化关系如图所示。已知:①G是黑色晶体,能吸附B单质;②H能与氢氧化钠溶液或盐酸反应;③实验时在G和C的混合物表面加入某强氧化剂粉末,在表面上插入一根除去氧化膜的E片,点燃E引发G与C的反应;④I是绿色植物光合作用的原料,温室中常用它作肥料。根据上述信息,回答下列问题:

(1)I的电子式为 ,G的俗名是 。
(2)以C和E为电极在NaOH溶液中构成原电池,该原电池的负极反应式为 。
(3)根据E和A反应的能量变化图像写出热化学方程式: 。
(4)两种常见含C元素的盐,一种pH>7,另一种pH<7,写出这两种溶液混合时发生反应的离
子方程式:
(5)写出B在高温下和水蒸气反应的化学方程式并标出电子转移方向和总数 。
A-G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且B为红棕色,C是红色的金属单质。它们之间有如下转化关系(其中反应③④⑦的产物中的水已略去)。试填空
(1)B的化学式________。
(2)反应⑤中氧化剂与还原剂的物质的量之比为 。
(3)写出反应⑦的离子方程式_____________________。
(4)写出电解X溶液的阳极反应式______________________;若电解一段时间后转移了0.2mol电子,则此时电解产生的气体在标准状况下的体积为 。
(5)写出反应④的化学方程式______________________。
下表是元素周期表的一部分,A、B、C、D、E、X是下表中给出元素组成的常见单质或化合物。
已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
(1)若E为单质气体,D为白色沉淀,A的化学式可能是 , C与X反应的离子方程式为 。
(2)若E为氧化物,则A与水反应的化学方程式为 。
①当X是碱性盐溶液,C分子中有22个电子时,则C的结构式为 ,表示X呈碱性的离子方程式为 。
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为 。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式 。t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的平衡常数K=1,D的转化率为 。
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
中学化学中常见的几种物质存在下图所示的转化关系。其中, A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C。(图中部分产物和反应条件已略去)。
试回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式 。
(2)将B的浓溶液与H的浓溶液混合,立即产生大量气体C,该反应的离子方程式为 。
(3)某课外小组同学用E溶液吸收C,利用下图所示装置向吸收液中持续通入SO2气体。实验过程中观察到如下现象:
①开始时,溶液上方出现白雾,试纸a变红。甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学认为使a变红的是
(写出一种即可)。
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝。用离子方程式解释b变蓝的原因: 。
③最终试纸b褪色。同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成IO3-,从而使蓝色消失;二是 。
下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
(1)物质G的化学式: 。
(2)物质B的电子式: 。
(3)写出C→E的化学方程式: ;
(4)G→F的离子方程式: 。
(12分)
Ⅰ.短周期元素组成的单质X2、Y,标准状况下X2的密度为3.17g·L-1;常温下,Y为浅黄色固体。Z是一种化合物,焰色反应呈浅紫色(透过钴玻璃);0.1mol·L-1 Z的水溶液pH=13。X2、Y 和Z之间有如下转化关系(其他无关物质已略去)
 (1)写出常温下单质X2与Z反应的离子方程式
(1)写出常温下单质X2与Z反应的离子方程式
(2)已知C能与硫酸反应生成能使品红溶液褪色的气体
①D的化学式是 ;D的水溶液pH>7,原因是(用离子方程式表示)
②将20mL 0.5mol·L-1 C溶液逐滴加入到20 mL 0.2mol·L-1 KMnO4溶液(硫酸酸化)中,溶液恰好褪为无色。写出反应的离子方程式
Ⅱ.下表是元素周期表的一部分,表中所列的字母分别代表某一元素.
某种金属元素的单质G,可以发生如下图所示转化:
其中化合物M是一种白色胶状沉淀;K的溶液与过量B的某种氧化物反应的化学方程式为___________________________;一种新型无机非金属材料由G元素和C元素组成,其化学式为 。
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题
(1)若常温下A为有色气体
①若F是一种金属单质,请写出B和适量F反应生成C与气体E的离子方程式:_________________ _____________。
②若C为直线型分子,E具有漂白性,物质F焰色反应呈黄色,请写出工业上制备物质F的化学反应方程式:_______ ____________;__________ _____。
(2)若A为淡黄色固体,则A物质的电子式为:_________________。
①若物质B和D的相对分子质量相等,物质C的大量排放往往会造成严重的环境问题即_____ _____;
②若物质A和D的相对分子质量相等,请用离子方程式表示物质F的水溶液呈酸性的原因_____ _____。
(3)若物质A中一种元素原子的最外层电子数为内层电子总数的1/5,将B和D分别溶于水,所得溶液按恰当比例混合,可得一不含金属元素的盐溶液,请写出A的化学式________。
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系: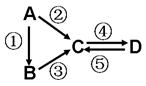
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。写出其中D与水反应生成的酸名称 。
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写③反应的化学方程式 。
(3)若D物质具有两性, ② ③ 反应均要用强碱溶液,④ 反应是通入过量的一种引起温室效应的主要气体。写④ 反应离子方程式 。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出② 反应的化学方程式 。
(5)若A是应用最广泛的金属。④ 反应用到A,② ⑤ 反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式 。
A、B、C、D、E五种物质均含有同一种元素,它们之间有如下转化关系:
(1)若A为单质,B、C均属于盐类,B的水溶液呈酸性,C的水溶液呈碱性,D是一种白色沉淀。写出下列过程的离子方程式:
①B的水溶液呈酸性____________。 ②C→D_______________。 ③E→C________________。
(2)若A~E均为化合物。A是淡黄色固体;B、C两溶液在等物质的量浓度时,C 溶液的pH较小。电解D的水溶液是最重要的工业生产之一,D→E→C也是工业制备C的普遍方法。
①A的电子式为__________。
②电解D的水溶液时,反应的离子方程式为________________。
③生铁浸入D溶液而发生锈蚀,正极的电极反应为________________。
(3)若A为单质,C、D的相对分子质量相差16,0.1mol/L E溶液中只有3种离子,且常温下溶液中的 =1012。
=1012。
①B→C的化学方程式为: 。
②A→C的反应中,每转移1 mol e-就会吸热45 kJ,写出该反应的热化学方程式: 。
下图为中学常见物质间的转化关系,其中甲、乙、丙、丁为单质,其余为化合物,甲单质所含元素最外层电子数等于周期数,C常温下为无色液体,B焰色反应为黄色。一些在溶液中进行的反应溶液中的H2O及生成的H2O已省略。
回答下列问题:
(1)单质乙所含元素在周期表中的位置______________________。
(2)化合物F的电子式________________________。
(3)D和G反应的离子方程式___________________________________。
(4)甲和A反应的化学方程式___________________________________。这类反应一般被称做________反应,该反应的主要应用_________________。(2种)
A、B、C、D、E、F、G七种元素均是短周期元素,且原子序数依次增大。A原子无中子, B、G原子的最外层电子数均为其电子层数的两倍,D、G元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙(甲、乙是高中常见的浓酸)均能反应(相对分子质量甲< 乙)转化关系如图(反应条件略去),原子E最外层电子数和其电子层数相等。元素F形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题:
(1)A2D的熔沸点比A2G高的原因是 。B、D、G各一个原子构成每原子均满足8电子的分子,其电子式是 。
(2)E4B3和水反应的化学方程式 。
(3)写出M与甲的浓溶液加热时反应的化学方程式 。
(4)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为 ;X、Y、W都能与Z反应,则Z的结构式为 。
(5)已知CH4 (g)+ 2O2(g)=CO2 (g)+2H2O(l) △H1=a kJ/mol
欲计算反应CH4 (g)+ 4NO (g)=2N2 (g)+CO2 (g)+2H2O(l)的焓变△H2 ,则还需要查找某化合反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时 △H3 =" b" kJ/mol,则该反应的热化学方程式为 。
据此计算出△H2 = kJ/mol(用含a和b的式子表示)。
如下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X和H是固体,B和G是液体,其余均为气体, 1 mol X分解得到A、B、C各1 mol。
试回答下列各题:
(1)写出下列物质的化学式:X________,B________。
(2)写出下列反应的化学方程式:
①H+G―→A+F:__________________________________________________________。
②C+D―→E:__________________________________________________________。
(3)写出下列反应的离子方程式:
G+Cu―→E:___________________________________________________________。
在下列物质转化关系中,反应的条件和部分产物已略去。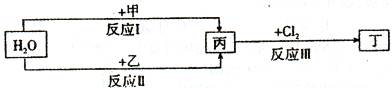
回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅰ是工业制盐酸的反应。
①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,
则工业上生产甲的一般方法是_ 。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应a的化学方程式是
③通过比较反应I、II的反应条件,可得出甲的金属性比乙的金属性_ (填“强”或“弱”)。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应II是化合反应。目前常用乙作为燃煤的脱硫剂,则乙脱硫的主要反应的化学方程
式是
②在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。其反应的离
子方程式是