在下列物质转化关系中,反应的条件和部分产物已略去。
回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应。
①反应Ⅰ中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是________(填字母)。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是______________________________________。
③通过比较反应Ⅰ、Ⅱ的反应条件,可得出甲的金属性比乙的金属性________(填“强”或“弱”),比较二者金属性强弱的依据还可以是(写出一种即可)__________________。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应Ⅲ的化学方程式是__________________________________________________。
②反应Ⅰ的另一种产物为有机物,则该有机物的电子式是______________。
③在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。其反应的离子方程式是______________________________________________。
(14分)下图所涉及的物质均为中学化学中的常见物质,其中A、C、G是中学化学常见单质,其中A、C是金属,G是气体,B是常见液体,它们存在如下转化关系,反应中部分反应物及次要产物均已略去。
(1)①→⑦中属于氧化还原反应的有______个,④的离子方程式是___________________
(2)实验室中常用反应⑦处理多余G,理论上处理标准状况下6.72L气体G,至少需要5mol/LNaOH溶液体积________,实验室中制取G的离子方程式______________________
(3)向M的溶液中加过量的氨水,写出对应离子方程式_________________________,露置,产物的颜色迅速变化,对应化学方程式是______________________________________
(4)图中有信息能表明A、C的活动性不同,用文字说明_______________________
已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为________________________
_________________________________________________________________。
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为_________________________________________________________________。
(4)已知下列几种试剂:
a.无水CuSO4
b.品红溶液
c.酸性KMnO4溶液
d.澄清石灰水
e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebd B.adeb C.abcbd D.abd
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应①的化学方程式为__________________,反应④的化学方程式为________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,反应②的离子方程式是_____________________________________.
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为___________________________________。
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为 (用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法: 。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有 。
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。请按要求回答下列问题:
(1)若B、C为氧化物且C对应的水化物为强酸。B转化为C时,质量增加25%,则氢化物A转化为B的化学方程式是 。
(2)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则B生成C的化学方程式是 ,将B的溶液加热蒸干再灼烧,得到的固体物质的化学式是__________。
(3)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式是__________________________________________;符合条件的D物质可能是________(填序号)。
①硫酸 ②醋酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
已知:
①单质中只有A为金属,在大气层高空释放的蒸气呈现明亮的橙黄色云雾,科学家由此可确定火箭在空中的位置;B、C、D为气体,E为固体;C、E为有色物质。
②B与D可以生成化合物J,A与J反应生成D和另一种化合物K,C与K反应的产物含漂白液的有效成分,F、G、I的水溶液呈碱性。
回答问题:
(1)化合物K的电子式为________。
(2)F的水溶液呈碱性的原因(用离子方程式表示)_________________________________,写出I与J反应的化学反应方程式__________________________________________。
(3)实验室制备C的离子反应方程式为_____________________________。
(4)D在C中燃烧观察到的现象是_________________________________。
(5)可利用B与D生成化合物J的反应制成燃料电池,若1 g D在B中燃烧生成气态J时,放出120.9 kJ的热量,已知1 mol J 在汽化时吸热44.0 kJ,写出表示D的燃烧热的热化学方程式_____________________________________________________,利用K作电解质溶液,写出该燃料电池的负极的电极反应方程式________________________。
下图是由常见元素组成的一些单质及其化合物之间的转化关系图。常温常压下,B、E、F、H、I均为气体,F无色无味,且能使澄清石灰水变浑浊;B、E、I均有刺激性气味,E能使湿润的红色石蕊试纸变蓝,B、E在空气中相遇会产生白烟,I为红棕色。A是一种常见的氮肥,F也能由A直接分解可得到。C、G、K的焰色反应呈黄色。(反应中部分生成物质已略去)
请回答下列问题:
(1)物质D的化学式为 ,其水溶液中阳离子的检验方法(文字表述) 。
(2)写出反应③的化学方程式________________________。
(3)写出反应④的离子方程式________________________。
(4)写出反应⑤的化学方程式,并用双线桥标出电子转移的方向和数目______________________________。
Ⅰ.下列化合物中,含有非极性共价键的离子化合物是 ( )。
| A.CaC2 | B.N2H4 | C.Na2S2 | D.NH4NO3 |
Ⅱ.图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。
回答下列问题:
(1)图B对应的物质名称是________,其晶胞中的原子数为________,晶体类型为________。
(2)d中元素的原子核外电子排布式为________。
(3)图A中由二种元素组成的物质中,沸点最高的是________,原因是________________________________________________________________________,该物质的分子构型为________,中心原子的杂化轨道类型为________。
(4)图A中的双原子分子中,极性最大的分子是________。
(5)k的分子式为________,中心原子的杂化轨道类型为________,属于________分子(填“极性”或“非极性”)。
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)F的组成元素在元素周期表中的位置______________。
(2)E与G的稀溶液反应的离子方程式为______________________。
(3)B和C反应的化学方程式为____________________________________。
(4)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式______________。
X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。
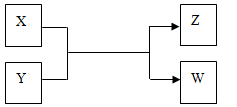
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)向FeCl2溶液中加入X的水溶液,是溶液颜色变为棕黄色的微粒是 。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途 。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是 。
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是 。
(2)若用下列装置只进行Z + W X + Y反应(夹持装置未画出):
X + Y反应(夹持装置未画出):
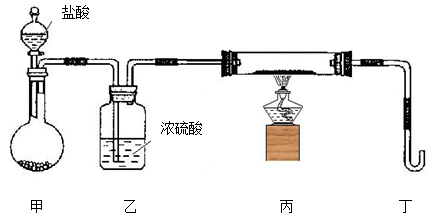
①完成此实验有多步操作,其中三步是:a.点燃酒精灯,b.滴加盐酸,c.检验气体纯度
这三步操作的先后顺序是 (填字母)。
②为保证实验成功,上述装置需要改进,方法是(用文字叙述) 。
(3)将3.48 g Z加入50 mL 4 mol/L的稀HNO3中充分反应,产生112 mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀。当沉淀量最多时,至少需要加入2 mol/L的NaOH溶液 mL (精确到0.1)。
Ⅰ.在甲溶液中通入过量CO2生成乙和另一种具有漂白性的物质,在乙溶液中滴加某钠盐溶液丙可以生成丁溶液(丁溶液呈中性),同时产生无色气体,已知题中所涉及的物质皆为中学化学中常见物质。回答下列问题:
(1)甲的化学式为 。
(2)写出乙在医疗上的一个用途 。
(3)在乙溶液中滴加丙溶液生成丁溶液的离子方程式 。
Ⅱ.固体化合物X由四种常见的短周期元素组成,可用作牙膏中的添加剂。现取39.3g化合物X进行如下实验:

实验结束后得到15.3g固体2和6.0g固体3,且固体1、固体2、固体3都可用作耐高温材料。回答下列问题:
(1)NaOH的电子式为 ,沉淀2的化学式为 。
(2)固体X的化学式为 。
(3)溶液1中加入足量NaOH溶液,反应的化学方程式为 。
(4)在高温下,固体3中某元素的单质可以与固体1发生置换反应,请写出此反应的化学方程式 。
(5)设计一个实验方案,比较固体2和固体3中两不同元素对应单质的活动性强弱 。
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
请问答下列问题:
(1)A是____________,G是______________。(填化学式)
(2)反应①-⑤中,属于氧化还原反应的是________________(填序号)。
(3)反应⑤的化学方程式为_______________________________________________________,
甲与B反应的离子方程式 _____________________________________________________。
在实验室将C溶液滴入F溶液中,观察到的现象是___________________________________。
在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:___________________________。
已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和 100g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去。(假设过程中液体体积不变)
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。
上述观点是否正确 ,请通过计算对比数据加以说明____________________________。
②乙同学认为“红色迅速褪去”是由于A + B = 碱 + H2O2 ,H2O2具有氧化性和漂白性导致的。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理 。
X是一种新型无机非金属材料,具有耐磨、耐腐蚀、抗冷热冲击性。有关生产过程如下: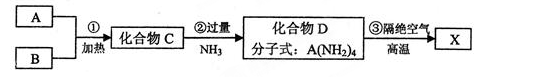
为了确定C的组成,某同学进行了以下的探究过程。已知F、G都是难溶于水和稀硝酸的白色沉淀,I可做光导纤维。
按要求回答下列问题:
(1)C的空间构型为 ;X的化学式为 。
(2)反应②的化学方程式为 。
(3)反应⑦的离子方程式 。
(4)E是重要的工业原料,常见工业制备E的方法存在着一定的局限性,现在设想用电化学的方法制备E,并向外界提供电能,则正极反应式为______________________________,现将该电池与另一如图所示的蓄电池充电,该电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,当制得2molE时,阳极质量__________(填“增重”或“减轻”) __________g。
2PbSO4+2H2O,当制得2molE时,阳极质量__________(填“增重”或“减轻”) __________g。
(14分)X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式)
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系
其中C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式 ;D的电子式 。
①如果A、B均由三种元素组成,B为两性化合物,且不溶于水,则由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因 。
A、B浓度均为0.1mol/L等体积的混合溶液中,离子浓度由大到小的顺序为 。