(12分)推断下列化合物的化学式:
(1)X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是__________;若XY2是共价化合物,其化学式是__________。
(2)第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其化学式为____。
(3)1 mol某共价化合物,含有三种短周期元素的原子各1 mol,且三种元素分别属于不同的周期,其质子总数为26 mol,其中一种元素的最外层有7个电子,则该物质的化学式为__________。
(4)某非金属X的最低负价为-2,它的最高价氧化物对应的水化物为强酸,则这种酸的化学式是__________。
(5)X元素的最高正价和负价绝对值之差为6,Y元素的化合价为+1,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则该化合物是__________。
根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%。
(1)A的化学式为 ; F的化学式为 ;
(2)反应 ③的化学方程式: ;
(3)反应②的离子方程式: ;
(4)反应④的离子方程式: ;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为: 。
已知:A、B、C、D、E、F在常温下均为气体,它们有以下转化关系(部分反应条件、产物已略去)。
请回答下列问题:
(1)将A点燃后伸入到装有E的集气瓶中,可观察到的现象是_________________.
(2)C的浓溶液与黑色粉末反应生成E的化学方程式为________________________。
(3)若将溶液Ⅱ滴入到碘化钾溶液中,发生反应的离子方程式为__________________,向反应后的溶液中加入适量CCl4,充分振荡后静置,可以观察到的现象是_______________。 (4)与溶液Ⅰ比较,溶液Ⅱ中多出的物质是 (填化学式)。
(4)与溶液Ⅰ比较,溶液Ⅱ中多出的物质是 (填化学式)。
下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于饮水消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
(1)用电子式表示H的形成过程____________________;
(2)写出E溶液与过量I溶液反应的离子方程式______________________________。
(3)实验室还可用C的浓溶液与F制备气体C,反应理由是__________________________________________________。
(4)物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A化学式为__________。
海水是巨大的资源宝库.如图1是从海水中提取食盐和溴的主要流程.

(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质.如图2是粗盐提纯的操作流程.

提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液.
①除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、
②如何证明操作①中NaOH溶液已经过量?
③蒸发过程所用的主要仪器有:铁架台、酒精灯、 、 ;
(2)某同学欲四氯化碳萃取较高浓度的溴水中的溴,经振荡并在铁架台上静置分层后,分离出四氯化碳层的操作:
(3)工业上将较高浓度的溴水经进一步处理得到工业溴.某研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为 59℃,微溶于水,有毒性和强腐蚀性.水的沸点为100℃.他们参观生产过程后,设计了如图3装置简图:

①图中仪器B的名称: ②温度计水银球的位置:
③实验装置气密性良好,要达到提纯溴的目的,收集溴时温度计应控制的温度为:
下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。请按要求填空:

(1)写出B的电子式:____________________。
(2)反应⑤的现象是_____________________________________________。
(3)反应①的化学反应方程式是______________________________________,
在实验室引发反应④的操作是____________________________________。
(4)反应⑥的离子方程式是_________________________________________。
(11分)如下图,A、B是中学化学里常用的物质,已知A是化合物,B是单质;E溶液中滴入KSCN溶液呈红色。试回答:
(1)B和A的浓溶液反应的条件是 ,简述常温下不易反应的原因 。
(2)写出F和G相互转化的化学方程式
F→G 。
G→F 。
(3)简述L转化为I的现象 ,该反应的化学方程式为 。
(9分) 在下列物质转化中,已知A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸;当X无论是强酸还是强碱时,都有如下的转化关系:
说明:当X是强酸时A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。(已知H2CO3、H2S、H2SO3、H2SiO3皆为二元弱酸)
请回答下列问题:
(1)A是 ,Y是 ,Z是 (填化学式,下同)。
(2)当X是强酸时,E是 ,写出B生成C的化学方程式: _____ 。
(3)当X是强碱时,E是 ,写出D生成E的离子方程式: 。
(13分)A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题: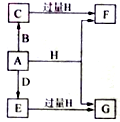
(1)A所含元素在周期表中的位置为 ,C的电子式为 。
(2)A与H在加热条件下反应的化学方程式为 。
(3)25℃时,pH均为10的H和G溶液,由水电离出的c(OH-)之比为 。
(4)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为 。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为 。
(5)向含有0.4mol F、0.1 mol G的混合溶液中加入过量盐酸,完全反应后收集到a L气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a= 。
物质A~I之间能发生如下反应(图中部分反应的条件和产物没有全部标出),其中A、B、C、I为金属单质,B是地壳中含量最多的金属,甲、乙、丙为气体。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:C__________、H____________。
(2)写出气体甲在气体乙中燃烧的化学方程式:_______________________;
该反应的现象有:______________________________。
(3)写出反应③的化学方程式:______________________;向反应③所得溶液中通入过量的CO2,写出反应的离子方程式:_________________________。
(4)写出反应⑤的离子方程式:____________________;
(5)检验物质D中阳离子的方法名称是:_____________________。
I:钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。

请回答下列问题:
(1)Fe位于元素周期表中第________周期,第________族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
Ⅱ:A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。

试回答:
(1)若X是强氧化性单质,则A不可能是________________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)____________。
(3)A还可以是氨气,氨气分子的空间构型是 。
(1)某无色溶液含下列8种离子中某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、
HCO3-、NO3-。已知该溶液可与Al2O3反应,则:
① 若溶液与Al2O3反应,有Al3+生成,则溶液一定有________,一定不含有________。
② 若溶液与 Al2O3反应,有AlO2-生成,则溶液一定有________,可能含有________。
(2)有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸钾溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,
用小试管各盛少量多次进行两两混合反应,反应现象为:A与B、A与E产生沉淀,B与D、B与E产生沉淀,C与E、D与E产生气体,而C与D无反应现象。
由此,可判定各试剂瓶中所盛试剂为:
A________,B________,C________,D________,E________。
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如下图所示:
请回答下列问题:
(1)若A为金属单质,B为非金属氧化物,则该反应的化学方程式为 ;请写出质量数为26的A的一种核素符号 。
(2)若A为非金属单质,B为非金属氧化物,且A、X为同主族元素,则该反应的化学方程式为 。
A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系。根据要求回答问题:
(1)若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染。写出D转化成C的反应化学方程式 。
(2)若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H 1、△H 2、△H 3,则它们之间的关系为_______________________(用含△H 1、△H 2、△H 3的代数式表示)
(3)若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,请写出工业上用D制备A的化学方程式__________________________。
(4)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种气态非金属单质。请简要说明实验室保存D溶液的方法 。
(共11分)在下列物质转化关系中,反应的条件和部分产物已略去。
回答下列问题:
(1)若甲、乙是两种常见金属,且反应Ⅲ是工业制盐酸的反应。
①反应Ⅰ中甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是 。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙在周期表中的位置 ;反应Ⅱ的化学方程式是 。
(2)若甲、乙是离子化合物,且反应Ⅲ是工业上制漂白粉的反应。
①反应Ⅲ的离子方程式是 。
②若反应Ⅰ是气体实验室制备的反应,该气体分子为14电子结构。则反应Ⅰ的化学方程式是 。
③在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。其反应的离子方程式是 ;写出HClO的结构式 。