(共5分)如图转化关系中A—H为中学常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体。已知单质乙、化合物A为黄色(或淡黄色)固体。乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程。B、F两种气体都能使澄清石灰水变浑浊。(部分反应物或产物略去)
(1)写出下列反应的化学方程式:
A与B ____________________________________________________
Cu与H ___________________________________________________
F与甲____________________________________________________
(2)写出丙与D溶液反应的离子方程式 _______________________________________
(3)常温时H的浓溶液与丙物质并不能看到明显的反应现象,原因是_________ ____ 。
(共8分)A、B、C、D、E、F六种物质的相互转化关系如下图所示,其中反应①是置换反应。
一.若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行。写出②的离子方程式:_____________________________
二.若A为金属单质,D为非金属单质,且所含元素的原子序数A是D的2倍,原子核外最外层电子数D是A的2倍,③④反应中都有红棕色气体生成,②③④反应中的部分产物已略去。写出①的化学方程式: ____ 写出④的化学方程式:
____ __;在②③④反应中F既表现氧化性又表现酸性的是(填序号)__ ______。
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
(1)写出A的电子式_____________。
(2)将X通入水玻璃溶液中,写出反应的离子方程式___________。
(3)自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________ g。
(4)写出区分B、C溶液的一种实验方案
由两种元素组成的化合物A存在如下图所示的转化关系(部分产物及反应条件已略去)。已知:E为红棕色气体,F、H为金属单质,J为黑色非金属单质。L露置于空气中时,由白色最终转化为红褐色,B与F反应时可生成C,也可生成G。试回答下列问题:
(1)物质K的名称是_________;I的晶体属于____________晶体。
(2)已知A中两种元素原子成最简整数比,且金属元素与非金属元素的质量比为14:1,则A的化学式为 。
(3)写出下列反应的化学方程式:
L露置于空气中时,由白色最终转化为红褐色____________。
A与B反应的化学方程式___________。
(4)H在D中燃烧的现象为____________。
(5)若各步反应都看成是进行完全的,则当生成a mol物质L时,需要A_________mol。
W、X、Y、Z四种化合物的焰色反应均为黄色,它们之间存在如下关系:
①W X+CO2↑+H2O
X+CO2↑+H2O
②Z+CO2 X+O2
X+O2
③Z+H2O Y+O2↑
Y+O2↑
④X+Ca(OH)2 Y+CaCO3↓
Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:
W 、X 、Y 、Z 。
(2)以上4个化学反应,属于氧化还原反应的是 (填反应序号),反应中氧化剂是
(写化学式),还原剂是 (写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应方程式:
① 。② 。
下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。
请填写以下空白:
(1)A的化学式 B的电子式 。
(2)写出下列反应的化学方程式:
D+G→ H 。
F+J → B + C + I 。
(3)写出题上:A+NaOH→D的离子方程式 。
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出):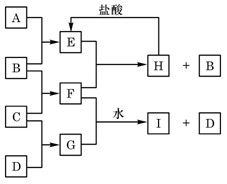
请填写下列空白:
(1)A ,C是 。
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液反应生成I和D的离子方程式是
下图每一个字母代表一种反应物或生成物。已知在常温下A是固体,B、C、E、F、G均为气态化合物,其中B、E为气态氢化物,X为空气中的常见成分之一。根据下列反应框图填空(有些反应条件已略去)。
(1)工业上C→D的设备名称是 ;
(2)当小心加热H与E化合生成的物质时,分解得到一种与CO2具有相同原子数目和相同电子数目的气体,同时还有一种无色无味的液体生成。试写出相应的化学方程式
_______ ___;
(3)I的浓溶液有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是 ;
A.酸性 B.脱水性 C.强氧化性 D.吸水性
(4)在铁和铜的混合物中,加入一定量的H的稀溶液,充分反应后剩余m1 g金属,再向其中加入一定量的I的稀溶液,充分振荡后,剩余m2 g金属,则m1 与m2之间的关系是 。
A.m1一定大于m2 B.m1 可能等于m2
C.m1一定等于m2 D.m1 可能大于m2
已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 |
a |
I |
e |
| 原子核数 |
单核 |
四核 |
双核 |
| 粒子的电荷数 |
一个单位正电荷 |
0 |
一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
请填写下列空白:
(1)写出下列物质的化学式:B J 。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为 。
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示。
请回答:
(1)写出B物质的化学式: ;F的名称: 。
(2)写出第③步反应的化学方程式为 。
(3)第④步反应中溶液颜色的变化 ;
(4)F溶液中滴入NaOH溶液可能产生的实验现象是 。
(本题共10分)A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。
请回答下列问题:
(1)A物质的名称为________。
(2)C与D在高温下的反应在冶金工业上称为 反应,化学方程式为________ ,引发该反应的实验操作是________________________ 。
(3)G→J的化学方程式为_________________________________。
(4)A→H的离子方程式为____________________________________。
(10分)原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如图所示的变化。
已知B分子组成中Z原子个数比C分子中少一个。
请回答下列问题:
(1) 元素X位于 周期 族
(2) 元素Y的原子结构示意图
(3) 用电子式表示B的形成过程:
(4) B与C的稳定性大小顺序为 (用化学式表示)
(5) C与X在一定条件下生成化合物A的化学方程式
(12分)化合物A是一种重要的光化学试剂。A~H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)
已知:化合物A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3∶1∶3。阴离子中各元素的质量分数与C相同且相对分子质量是C的2倍。C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑浊,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使KSCN溶液显红色。
回答下列问题:
(1)C的电子式为: ;A的化学式为: 。
(2)D+E→C+G的化学方程式: 。
(3)H+H2O2+HCl→I的离子方程式: 。
(4)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是
_________________________________________________________________________。
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系。回答下列问题:
(1) 若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子, Y原子的基态轨道表示式为 ,乙的电子式为 。
(2) 若X基态原子外围电子排布式为3s1,甲是由两种短周期元素的原子构成的AB4型非极性分子,且是常见的有机溶剂,甲的电子式 ,乙的化学式为 。
(3) 若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为: ,Y原子基态电子排布式为 。