已知A、B、C、D为气体(其中A为黄绿色),E是常见的氮肥,F为固体,G是氯化钙,它们之间的转换关系如下图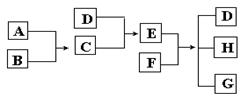
⑴ D的结构式是_____________,E的化学式(分子式)是_____________。
⑵ D和O2反应的化学方程式是______________________________。
⑶ E和F反应生成D、H和G的化学方程式是___________________________________。
已知A、B、C、D为气体(其中A为黄绿色),E是常见的氮肥,F为固体,G是氯化钙,它们之间的转换关系如下图
⑴ D的结构式是_____________,E的化学式(分子式)是_____________。
⑵ D和O2反应的化学方程式是______________________________。
⑶ E和F反应生成D、H和G的化学方程式是___________________________________。