有A、B、C、D四种元素,A元素形成的离子中只有一个质子,B原子的最外层电子数是次外层的3倍,C元素的一价阳离子核外有10个电子,D元素的原子得到一个电子后能形成与氩原子电子层结构相同的离子。回答下列列问题:
(1)画出D元素的离子结构示意图__________________;
(2)工业上用电解C和D两元素形成的化合物的水溶液生产D的单质,写出该反应的化学方程式_______________________,电解后的溶液能使酚酞变红的是与电源的________极相连接的区域;
(3)D单质能和A、B、C三元素形成的化合物反应,该反应的化学方程式是________________,当有0.1mol的D单质反应时,电子转移__________个;
(4)B、C、D三元素能形成一种化合物,1mol该化合物中有36mol电子,该化合物的水溶液是一种____剂,它与A、D两元素形成的化合物的水溶液反应时能产生一种有毒气体,该反应的化学方程式是______。
常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如右图的转变关系,试回答:
(1)A是 、B是 、C是 。
(2)B的物质的量为x,氧气的物质的量为y,则当B跟氧气恰好反应,完全转化为A时,x与y的数值关系为 ;若当B转化为C时,反应后,常温下体系中只有C一种气体, x与y的数值关系是 。
(14分)金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下:
已知,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1) A和B两溶液混合产生白色沉淀,该白色沉淀的化学式
(2) C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式
(3)完成铝在碱性条件下与NO3-反应的离子方程式 。
(4)过量D的水溶液与A溶液反应的离子方程式是 。
(5)D→C反应的化学方程式是 。
(6)除去气体C中的杂质气体E的化学方法: (用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
已知物质M由X、Y两种短周期元素且同周期元素组成,X原子的最外层电子数是最内层电子数的1/2 ,Y元素最高正价与它的负价代数和为6。M与其它的物质的转化关系如下(部分产物已略去)。
(1)若A是X、Y同周期元素的一种单质,当F的水溶液过量时,G为可溶性盐,当F的水溶液不足时,G为沉淀,则E与过量F溶液反应的离子方程式
是 。
(2)若A是一种常见酸性氧化物,且可用于制造玻璃,则A与B反应的化学方程式是 。
(3)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、A13+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时,发现生成沉淀的物质的量随B溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是 ,且各阳离子的物质的量之比为 。
已知:甲、乙、丙为常见单质,甲常温下为固体,乙为黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为红褐色沉淀,它们之间有下图转化关系。请回答以下问题。
(1)写出下列物质的化学式;乙 ;B 。
(2)写出③反应的化学方程式: 。
(3)写出②反应的离子方程式: 。
下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)B的电子式为 ;
(2)写出B和C反应的化学方程式 ;
(3)写出E与G的稀溶液的离子方程式,写出电子转移数目: , ;
(4)汽车尾气中常含有D和CO,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,已知:F(g) + A(g) =" 2D" (g) ;△H =" +180.5KJ/mol"
2C (s)+ O2 (g)=" 2CO(g)" ;△H =" -221.0" KJ/mol
C (s)+ O2(g) = CO2(g);△H =" -393.5" KJ/mol
则上述尾气转化的热化学方程式为: 。
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空:
(1)若A可用于 自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,则B的化学式可能是 ;实验室制取A的离子方程式为 。
自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,则B的化学式可能是 ;实验室制取A的离子方程式为 。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,则反应①的化学方程式为 。
(3)若B有两性,则反应②的离子方程式是 。
(4)若D为空气质量预报必报的气体,A、B、C的的焰色反应都呈黄色,则可以证明B是否变质的一组试剂是 (请写出 试剂名称)。
试剂名称)。
(5)若C是淡黄色固体,D是一种常见气体,则B→ C反应的化学方程式为 ,C的电子式为 。
在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。
回答下列问题:
(1)A、G的化学式分别为___ ___、____ __。
(2)A和E反应的离子方程式为__ ____。
(3)写出反应①的化学方程式,并用双线桥法表示出电子转移的情况_ _____。
(4)在反应②中,每生成2.24 L气体G(标准状况)时,消耗F _ ___g。
A、B、C、X均为中学常见的纯净物,它们之间有如图转化关系(副产物已略去)。
回答下列问题:
(1)若X是强氧化性单质,则A不可能是________。
a.S b.N2 c.Na d.Mg e.Al
(2)若A、B、C为含金属元素的无机化合物,X为强电解质溶液,A溶液与C溶液反应生成B,则B的化学式为________,X的化学式可能为(写出不同类物质)________或________,反应①的离子方程式为________________________或________________________。
工业上制取铝的流程如下: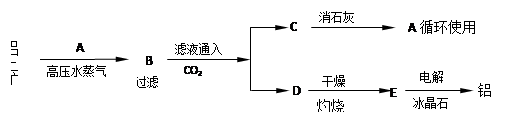
注:冰晶石的作用是使E在较低温度下熔化。
(1)试写出下列物质的化学式:
A ,B ,C ,D ,E 。
(2)在用此法制取铝时,分析铝土矿和赤泥(提取Al2O3之后的残渣)所得数据如下:
| |
Al2O3 |
Fe2O3 |
Na2O |
| 铝土矿 |
55% |
16% |
0% |
| 赤泥 |
15% |
48% |
8% |
试求制取1t Al2O3所需铝土矿和苛性钠的质量。(写过程)
已知A、B、C、D的组成元素都属于短周期元素,其中A、D为单质,B、C为化合物,它们之间的关系转化如下图所示,请按要求写出有关反应式,是离子反应的只写离子方程式。
(1)若A、D的组成元素同主族:
①B是水
②B、C均为氧化物:
(2)若A、D的组成元素不同主族
①B是水且水是还原剂:
B是水且水是氧化剂
②B、C均为氧化物
由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,A是地壳中含量最多的金属元素。请回答:
(1)写出下列物质的化学式:乙 、丁 、戊 。
(2)写出甲物质在工业上的一种主要用途: 。
(3)写出甲→乙+丙反应的离子方程式: ;
A→乙+C反应的化学方程式:
已知A、B、C是单质,其中A是金属,各物质间的转化关系如图:
回答下列问题:(1)写出下列物质的化学式(各1分):
(1)A:________、B:________、乙:________、
丙:________、丁:________、戊:________
(2)写出A与NaOH溶液的化学方程式 ;
写出丁生成戊的离子方程式 ;
A、B、C、D、E、F是中学化学中常见的气体,G是一种固体非金属单质,它们具有如下的性质:
①A、B、E能使湿润的蓝色石蕊试纸变红,F能使湿润的红色石蕊试纸变蓝,C、D不能使湿润的石蕊试纸变色。
②A和F相遇产生白烟。
③B和E都能使品红溶液褪色。
④将红热的铜丝放入装有B的集气瓶中,瓶内充满棕黄色的烟。
⑤C和D相遇生成红棕色气体,且D可助燃。
⑥G是常见的半导体材料
回答下列问题:
(1)A的化学式是 ,②中的白烟是 (填化学式)。
(2)④中发生反应的化学方程式是
(3)C的化学式是 ,E的化学式是
(4)写出工业上制G的化学方程式
(5)B是一种有毒气体,实验室可用 吸收B,反应的离子方程式是
写出实验室制取B的化学方程式
根据反应框图填空,已知反应①~⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120。
(1)I元素在元素周期表中的位置_ ______;M中阴离子的结构示意图: 。
(2)固体A中所包含的化学键与固体Na2O2类似,则A的电子式为 。
(3)写出反应①所使用设备的名称___________________。
(4)写出下列化学反应的离子方程式:
① 反应⑤:______________________________________________ ___;
② G与N的反应:________________________________________________;
③ K与L的反应:________________________________________________。
(5)已知每生成16 gD,放出106.5 kJ热量,则反应① 的热化学方程式为:
的热化学方程式为:
。