由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,A是地壳中含量最多的金属元素。请回答: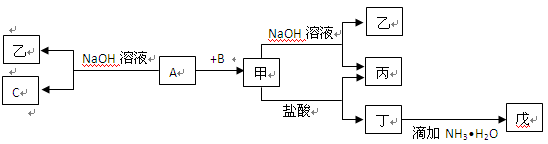
(1)写出下列物质的化学式:乙 、丁 、戊 。
(2)写出甲物质在工业上的一种主要用途: 。
(3)写出甲→乙+丙反应的离子方程式: ;
A→乙+C反应的化学方程式:
由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,A是地壳中含量最多的金属元素。请回答:
(1)写出下列物质的化学式:乙 、丁 、戊 。
(2)写出甲物质在工业上的一种主要用途: 。
(3)写出甲→乙+丙反应的离子方程式: ;
A→乙+C反应的化学方程式: