已知A—L所代表的物质(溶液中的溶质),除B外均是中学化学里常见的物质,它们的转化关系如图所示。(反应时加入或生成水均略去)
已知:a.通常状况下,A是淡黄色固体,C是红棕色固体,D是气体单质,E是无色无味气体;b.反应②—③是工业生产L的部分反应,反应④是工业生产普通玻璃的反应之一;c.B是由两种元素组成的化合物,其质量比为7:5;请填写下列空白:
(1)A的电子式 ,B的化学式 。
(2)反应②的工业生产条件 ,写出工业生产L时反应①的设备名称 。
(3)完成下列反应方程式:
①I+G→M+L的离子方程式: ,
②反应④的化学方程式: 。
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
试回答:
(1)若X是强氧化性单质,则A不可能是 。
a、S b、N2 c、Na d、Mg e、Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,
则B的化学式为 ;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示) ,检验此C溶液中金属元素价态的操作方法是
_____________________________________________________________________________。
(3)若A、B、C为含金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ,X的化学式可能为(写出不同类物质) 或 ,反应①的离子方程式为 或 。
(12分)如图所示:下图为A → E五种含同种元素的物质相互转化的关系图,其中A、B、C、D常温下都是气体,D呈红棕色。按要求回答下列问题:
(1) A物质的电子式 ;B物质是含 键
的 分子(填“极性”或者“非极性”)
(2)下列反应的化学方程式为:
①B→C:
②D→E:
(3)实验室制取B的化学方程式为: ,通常用 来干燥B气体;
已知B可以与灼热的氧化铜反应得到A气体和金属铜,则该反应的化学方程式为: 。
A、B、C、W、X、Y、Z是由周期表中短周期元素组成的七种物质,其中A、B、C是三种固体单质,W、X、Y、Z是由两种元素组成的化合物。它们之间的转化关系如图所示(所有反应物和生成物均未在框图中:
回答下列问题:
(1)化合物Z的晶体类型属于__________晶体。
(2)写出单质C的一种用途__________________________________。
(3)航天科技测知化合物N是金星大气层的成分之一,组成化合物N的元素与W相同。已知N中两种元素的质量之比为2:1,N的相对原子质量小于80,则N的化学式为_____________。又知该分子中的每个原子都满足最外层8电子的稳定结构,试写出其电子式_________________。
(4)写出下列反应的化学方程式:
①__________________________________;
②__________________________________。
阅读下表中短周期主族元素的相关信息。
| 元素代号 |
相关信息 |
| A |
A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B |
B的原子最外层电子数是其内层电子数的三倍 |
| C |
在第3周期元素中,C的简单离子半径最小 |
| D |
A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E |
所有有机物中都要有E元素 |
请回答:
(1)在一定条件下,B2与C的单质在海水中可形成原电池,为新型海水航标灯提
供能源。 写出该原电池正极的电极反应式 。
(2)用惰性电极电解化合物AD的水溶液,该反应的化学方程式为:
其中,阴极产物是
(3)常温下,0.1 mol·L-1X溶液的pH_____7(填“>”、“=”或“<”),原因是 (用离子方程式说明)。向1.5 L O.1 mol·L-1 A的最高价氧化物对应水化物的水溶液中通人标况下2.24L EB2,充分反应后,溶液中各离子浓度由大到小的顺序是 。
(4)已知 mol4·L一4。现向pH=0,浓度均为0.04mol·L-1的Al3+、Fe3+溶液中加入A的最高价氧化物对应水化物的溶液,以调节pH(设溶液体积不变),该过程中Al3+、Fe3+的浓度与pH关系正确的是
mol4·L一4。现向pH=0,浓度均为0.04mol·L-1的Al3+、Fe3+溶液中加入A的最高价氧化物对应水化物的溶液,以调节pH(设溶液体积不变),该过程中Al3+、Fe3+的浓度与pH关系正确的是
(填字母代号)。
A、B、D、X、Y是由短周期元素组成的化合物,其中X、Y分别是常见的强酸、强碱。它们存在如下图转化(部分生成物和水略去)。
(1)若A、B均为气体,在水溶液中反应生成正盐D,其中A是形成酸雨的主要物质。则D的化学式是 。B发生催化氧化反应的化学方程式是 。
(2)若A、B、D含有相同的金属元素,则此元素在元素周期表中的位置是 ,工业上制取该金属单质的化学方程式为: ,现将X滴入B的溶液中至过量,该过程发生的离子方程式为: 。
(3)若A为无色无味的气体,B为盐,且A、B、D三种物质含有相同元素,则A的电子式为: ,A与B溶液反应生成D的离子方程式为: 。
下图所涉及的物质均为中学化学中的常见物质,其中C为气体单质一种主要成分、D在常温下是黄绿色气体、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出有关物质的化学式
F ,G ,H 。
(2)指出MnO2在相关反应中的作用,反应①中是 剂,反应②中是 剂。
(3)若反应①是在加热条件下进行,则A是 ;若反应①是在常温条件下进行,则A的电子式为 。
(4)写出B与MnO2共热获得D的离子方程式
。
(5)写出B与F反应的化学方程式 。
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素。
(1)若A为固体非金属单质
①D的化学式为
②C→D的化学方程式
(2)若A为气态非金属单质
① D物质的颜色是
②A→B的化学方程式
③E→C的离子方程式为 。
A~J都是初中化学中的常见物质,其中D、E对维持自然界生命活动至关重要,A、B为黑色固体,C是红色金属单质,H为气体。它们的相互转化关系如下图所示。
请回答下列问题:
(1)写出下列物质的化学式:B , D ,
I , J 。
⑵反应①③④⑤中属于置换反应的是 (填序号)
⑶写出反应④的化学方程式 ,
有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略)。已知A和B是单质,B、E、F 在常温下为气体,C为淡黄色粉末。
试回答:
(1)写出A、B、的化学式:A__________; B__________。
(2)写出C和D反应生成E 的化学方程式: _____________________________________。
(3)写出C和F反应生成E 的化学方程式:_____________________________________。
(4)写出C物质的电子式___________________,F的结构式 _____________________。
(5)用电子式表示D的形成过程:_______________________________。
下图是A~ O 的转化关系。已知A是一种金属单质,B、C、D、E、F、H、I、J、K常温常压下均为气体,且B、C、D、E是单质,I是一种红棕色气体,G是一种淡黄色固体,M是混合物,含有气体,J与K相遇会产生大量白烟。请回答下列问题: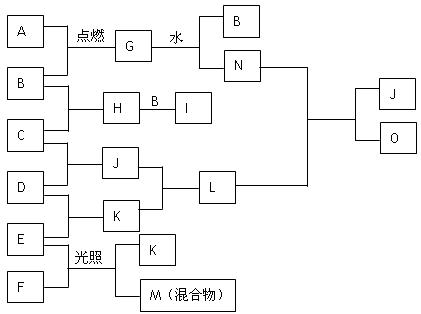
(1)写出G与水反应的化学方程式 ;写出气体E与N溶液反应的离子方程式 。
(2)化合物G中含有的化学键为 。
(3)写出F的电子式 ,化合物O的电子式 。
(4)E与F反应生成气体的化学方程式为 。
A~N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产中的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。
回答下列问题:
(1)H的化学式为________________________,D的电子式为_____________。
(2)工业上用A制取N反应的化学方程式为:____________________________________。
(3)I的饱和溶液滴入沸水中反应的离子方程式为:______________________ _______。
(4)G与M反应的化学方程式为_____________________________________ _______。
以下框图是无机物A ~ N的转化关系(部分产物及反应条件未列出)。已知E、F、G、J为单质,且E、F为金属单质;物质M、M′由相同元素组成,M′是黄色固体,M′常用于工业上制取A;D、I也由相同元素组成,I为黑色有磁性的晶体;B是有臭鸡蛋气味的气体,C是有刺激性气味的气体。请根据以上框图填写以下空白:

(1)B的电子式是______________;
B分子属_________分子(填“极性”或“非极性”);
(2)B与C气体间反应的实验现象是
;
将E或F金属片放入A的浓溶液中,现象是___________ ____________________;
(3)用石墨作电极,以碱性锌锰干电池电解H,己知干电池总反应为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,阳极的电极反应式是 。当生成J的气体体积为11.2L(标准状况)时,干电池消耗的负极材料质量为 g;
(4)C与N溶液反应的离子方程式是 ;
I溶于稀硝酸的离子反应方程式为 ;
(5)过量F溶于HI的溶液,取所得溶液再与过量稀HNO3反应的离子反应方程式为:
;
(6)在化工生产中,由M′制A,现有100T质量分数为80℅的M′参加反应,若几步反应总的转化率为80℅,则可生成98℅的A溶液 T(结果保留一位小数)。
饱和盐溶液W的电解产物发生下列系列反应。图中的每一方格表示有关的一种主要反应物或生成物(反应中加入或生成的水以及生成的其它产物已略去),其中A、B、C、D、E在常温下均为高中化学中常见气态物质,X和K是中学常见的金属单质,氧化物Y是一种比较好的耐火材料。



回答下列问题:


①W的名称是 ,G的俗名是 。
②A分子的空间构型是 ,键角是 ° ′。
③反应(3)的化学方程式是 。
反应(4)的化学方程式是 。
④饱和盐溶液W电解的离子方程式是 。
⑤已知C的燃烧热为285.8kJ/mol。试写出C完全燃烧生成液态物质的热化学方程式 。