甲是一种盐,由A、B、C、D、E五种短周期元素元素组成。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
③取少量甲溶液于试管中逐滴滴入NaOH溶液,生成沉淀的质量与滴入NaOH溶液的体积关系如图所示;
④取少量甲溶液于试管中,加入过量NaOH溶液并加热;
回答下列问题:
(1)D在周期表中的位置 写出化合物AB3的电子式
(2)经测定甲晶体的摩尔质量为453 g/mol,其中阳离子和阴离子物质的量之比1:1,且1 mol 甲晶体中含有12 mol结晶水。则甲晶体的化学式为 。
(3)实验③中根据图像得V(0a):V(ab):V(bc)= 。
(4)实验④中离子方程式是 。
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是
| A.若甲既能与盐酸反应又能与NaOH溶液反应则丙可能属于两性氧化物 |
| B.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 |
| C.若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用 |
| D.若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊 |
(共6分)常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。
(1)写出单质X的结构式是__________________________;
(2)化合物甲的电子式是_____________________________;
(3)化合物丙中存在的化学键是__________________________。
(7分)某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3-、NO3-、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出)。
请回答下列问题:(1)根据上述框图信息填写下表(不能确定的不填):
| |
肯定存在的离子 |
肯定没有的离子 |
| 化学式或离子符号 |
|
|
(2)写出沉淀A三种可能的情况:______________________________,若气体D遇空气变红棕色,则生成沉淀D时肯定发生的反应的离子方程式为 。
(3)若Mn+位于第三周期,则要确定它具体是何种离子的方法是_____________________。
已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
请回答下列问题:
(1)组成B单质的元素在周期表中的位置是_________________________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是________________________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:___________________________。
(4)写出D与足量的N反应生成E和F的化学方程式:_________________________________。
(5)上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有_______个。
下表是元素周期表的一部分,针对表中的①~⑩中10种元素用元素符号或化学式填空回答以下问题:
Ⅰ.填写下列空白:
(1)非金属性最强的元素是 (填元素符号),其离子结构示意图为 。
(2)写出②的氢化物的电子式: ,该氢化物的水溶液显______(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式: 。
(3)最高价氧化物对应的水化物中碱性最强的是 ,写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为: 。
(4)写出由③⑤⑩三种元素组成、且暴露空气中易变质的化合物化学式: ;该化合物含有化学键类型有: ;
写出该物质暴露空气中变质的化学方程式: 。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一种淡黄色固体,可作供氧剂。X是一种氢化物,常温下为液体。则:
(1)写出A的晶体中存在的作用力有: ;
(2)气体Y是一种大气污染物,无色、有刺激性气味的,直接排放会形成酸雨。写出气体C与气体Y反应的化学方程式: ;
(3)在100 mL 18 mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2 L(标况下),则反应过程中转移的电子数为 。
某常见二价过渡金属的盐A可发生如图所示的变化,其中B为黑色固体氧化物;C、G为气体氧化物;E为固体单质且不与稀H2SO4反应;D为气体单质;E与F反应时,除生成A外随F的浓度不同产物可以是C也可以是G。
请完成下列问题:
(1)A的化学式 ,D的化学式 。
(2)B转化为E时,有多种方法,请写出其中一个反应的化学方程式 。
(3)C与H2O反应的化学方程式为_ 。
(4)写出E与足量F的浓溶液反应的实验现象: 。
(5)A分解时生成C和D的物质的量之比为 。
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应①的化学方程式为__________________,反应④的化学方程式为________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,反应②的离子方程式是_____________________________________.
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为___________________________________。
X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,X的单质只有氧化性.
(1)写出实验室制取W2反应的离子方程式 .
(2)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究YX2和W2的性质.
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”) ;若装置D中装的是铁粉,当通入W2时D中观察到的现象为 ;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为 .
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母) ,可以看到白色沉淀生成,其原因为 ______________________(写出其中一种即可).
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 |
(4)若由元素Y和X组成—2价酸根Z,Z中Y和X的质量比为Y:X=4:3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生.写出W2与Z的溶液完全反应产生浅黄色沉淀的离子方程式 .
已知X、M都是中学教材中的常见元素,下列对两个离子反应通式的推断中,其中正确的是
(甲) XO3n-+Xn- + H+ →X单质+ H2O(未配平)
(乙)Mm++mOH-=M(OH)m↓
①若n=1,则XO3n-中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
| A.①③ | B.④⑤ | C.①② | D.②③ |
(共17分)各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板。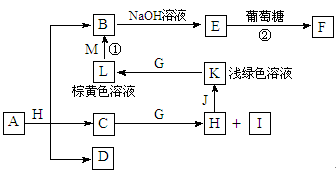
请回答下列问题:
(1)G元素在周期表中的位置_________________,C的电子式____________________。
(2)比较Y与Z的原子半径大小______>______(填写元素符号)。
(3)写出E和乙醛反应的化学反应方程式(有机物用结构简式表示) ;反应类型: 。
(4)写出实验室制备G的离子反应方程式 。
(5)气体D与NaOH溶液反应可生成两种盐P和Q,在P中Na的质量分数为43%,其俗名为 。
(6)实验室中检验L溶液中的阳离子常选用 溶液,现象是 。
(7)A中包含X、Y、Z元素,A的化学式为 。
(8)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其1种同素异形体的名称______________、____________。
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
(1)若A为非金属单质,C、D的相对分子质量相差16。0.05 mol·L—1 E溶液中只有3种离子,且在25℃时,溶液中的c(H+)/c(OH—)=1012。
①写出E→C的一个化学方程式___________________________;
②在A→C的反应中,每转移1 mol e— 就会放热 143.5 kJ,该反应的热化学方程式为_________。
(2)若A为金属单质,B、C均属于盐类,D是一种白色沉淀。
①若B水溶液呈酸性,C水溶液呈碱性,则B溶液呈酸性的原因是______________(用离子方程式表示);
②若B溶液呈黄色,与硫氰化钾溶液混合后显红色,E是一种不溶性碱。B→C的离子方程式为___________。D→E的化学方程式为______________________。选用氢碘酸与可E反应实现E→C的转化,该反应的离子方程式为________________。
(3)若A~E均为含有Y元素的化合物,A是淡黄色固体,等物质的量浓度B、C两溶液,其中C溶液的pH较小。电解D的水溶液是最重要的工业生产之一,D→E→C是工业侯氏制碱中的主要过程。则等浓度、等体积混合的C、E两溶液中所有离子浓度的大小关系为________________。
下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。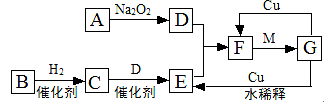
(1)物质G的化学式为 ;物质F的名称是 。
(2)①A→D的化学方程式为 ;
②C→E的化学方程式为 。
(3)G→E的离子方程式为 。
A、B、C、D为为中学常见单质。通常状况下,A为固体,B为黄绿色气体,C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体。它们之间转化关系如下图所示(其中某些反应条件和部分反应物已略去)。
请回答下列问题:
(1)写出下列物质的化学式:A______、X______。
(2)在反应;①~⑦中,属于氧化还原反应的有____个;反应⑥说明D溶液中含有___离子。
(3)反应④的离子方程式是__________。
(4)反应⑦的化学方程式是__________。
(5)检验D的溶液中是否含有G离子的方法是_________。
(6)除去D溶液中混有的少量G的方法是_____________。
【原创】Ⅰ.(6分)将等物质的量的Fe2O3与FeCl3置于密闭管中加热,能恰好完全反应,且只生成一种产物X,其物质的量是反应物总物质的量的1.5倍,已知产物X难溶于水,易溶于强酸。
(1)产物X的化学式为 ;
(2)写出X溶于稀盐酸的离子方程式 ;
(3)某小组将X固体与足量钠在隔绝空气条件共热,发现有一种新的单质生成。设计实验证明这种单质。
。
【改编】Ⅱ.(12分)无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D。加热D发现无任何物质存在,把D溶于水测得溶液的pH小于7。已知气体C在标准状况下的密度为0.76g·L―1。
(1)A的化学式为 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
(3)1molSCl2能与2mol乙烯发生加成反应生成一种化学毒气芥子气,写出发生反应的化学方程式 。
(4)亚硝酸钠和D固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。