现有四瓶贴有A、B、C、D标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液。现进行如下实验,并记录部分现象(如下图):

据此完成下列回答:
(1)写出各物质的化学式
A、 B、 C、 D、
(2)写出下列反应的离子方程式:
A + B反应:
沉淀a+溶液b:
(3)检验物质D中阴离子的方法为
(说明实验操作、现象与结论等)。
[本题包括2小题,文选班同学做第一小题。理选班同学做第二小题]
(1)已知A是应用最广泛、用量最大的一种金属单质,B是黑色固体,C是气体单质,在一定条件下有如下转化关系:
写出A、B、C各物质的化学式:
A B C
(2)室温下,单质A为日常生活中使用最广泛的金属;单质B为黄绿色气体,单质C为常温常压下密度最小的无色气体。在合适的条件下,它们可以按如图所示进行反应,又知D溶液为黄色,E溶液为无色。
写出下列物质的化学式:
D E F
下列两个反应的反应原理是否存在矛盾?为什么?
①Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3
H2SiO3↓+Na2CO3
②siO2+Na2CO3 Na2SiO3+CO2↑
Na2SiO3+CO2↑
从降低成本和减少环境污染的角度考虑,制取硝酸铜最好的方法是( )
| A.铜和浓硝酸反应 | B.铜和稀硝酸反应 |
| C.氧化铜和硝酸反应 | D.氯化铜和硝酸银反应 |
将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
| A.1mol | B.0.05mol | C.1.05mol | D.0.11mol |
(14分)已知A是一种含两种元素组成的液态有机溶剂,N带有磁性,B、F、L、O、P是中学化学常见单质, B、D、F、J都含有一种相同的元素且它们的相对分子质量关系是M(D)=2M(B)=2M(F),A和B反应前后气体体积(常温常压)保持不变,I是一种常用的氮肥,反应①②③均是化工生产中的重要反应。
⑴A的化学式___________。
⑵写出反应①的化学方程式_______________________________。
在工业上叫______________
⑶高温下反应⑤⑥互为可逆反应,写出反应⑥的化学方程式___________________
(4)写出在加热条件下单质F与单质L的化学反应方程式___________________________。
(5)请设计一个实验方案,完成反应④,并在答题卡指定位置绘出实验装置图。
物质之间的转化关系如下图,其中A、D、E、F、H为常见单质,其余为化合物,且单质E和单质F在点燃或加热的条件下生成淡黄色的固体,B常温下为液态化合物。 
试回答下列有关问题:
(1)A在元素周期表的位置 周期 族
(2)以上7个化学反应属于非氧化还原反应的是 (用编号①→⑦填写)
(3)写出反应①是 ;
(4)写出引发反应④的实验操作
写出该反应一种重要的工业用途
(5)反应⑤的化学方程式是 。
(5)写出用A与H作电极材料插入G溶液闭合电路后的正极反应式是
。
有X、Y、Z、W四种短周期元素原子序数依次增大,它们之间可以同时相互形成A2B2型、AB型、A2型、A22—型等具有相同电子数的微粒。
(1)当A2型微粒为空气的主要成分时:
①写出上述A22—型微粒电子式 _______________。
②写出四种元素原子按5:1:1:3形成的离子化合物与足量NaOH反应的离子方程式_______________。
(2)当A2型微粒为最活泼的单质时:
①1mol A2B2型化合物分解转移电子的物质的量为_______。
②任写出一种具有相同电子的其他非极性分子的有机物化学式__________
③比较Z与W两种元素的氢化物的沸点与水溶液的酸性。沸点________________酸性______________。
现有E、F、H、I、G、K六种原子序数依次增大的前四周期主族元素,且分属四个不同周期,E、G同主族,F、H、I为同周期相邻的三种元素,其中F元素形成的化合物种类是所有元素中最多的,I、G简单离子具有相同的电子层结构,K与F形成的离子化合物Q与E和I形成的常见共价化合物R之间的反应是实验室常见的可燃气体制备原理。(题中的字母只代表元素代号,与实际元素符号无关),请回答下列问题:
(1)E~K六种元素原子,原子半径第三大的是 (填对应的元素符号,下同)。
(2)E与H两种元素组成一种阳离子,该离子的结构式为 。
(3)I、G两种元素组成含有两种化学键的化合物,该化合物的电子式为
。
(4)下图为常温下向25mL 0.1 mol·L-1由E、I、G组成的化合物W溶液中逐滴滴加0.2 mol·L-1E、F、I组成相对分子质量为60的一元酸Z溶液过程中溶液pH的变化曲线。 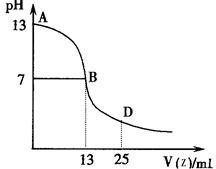
①上图能确定Z为 (“强”或“弱”)酸,理由是
②B点溶液呈中性,有人据此认为,在B点时W与Z恰好完全反应,这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)。
(5)写出Q与R之间的化学反应方程式 。
(11分)有A、B、C三种元素,A元素是所有元素中原子半径最小的元素,B、C两元素的核外电子层数相同,C元素的单质为深棕红色液体,B元素的最高价阳离子0.5 mol被还原成中性原子时,需得到1 mol电子,当它同盐酸反应时,放出0.02 g H2,用去B元素0.4 g,则
(1)A元素为______________,B元素为______________,C元素为_______________。
(2)用电子式表示A与C,B与C形成化合物的过程:______________、______________,化学键分别是_________________、_________________。