物质有下图所示转化关系(部分反应物、生成物没有列出)。其中
为某金属矿的主要成分,经过一系列反应可得到
和
。单质
可与
的浓溶液发生反应,
为砖红色沉淀。

请回答下列问题:
(1)写出下列物质的化学式:、
、
;
(2)利用电解可提纯物质,在该电解反应中阳极物质是,阴极物质是,电解质溶液是;
(3)反应②的化学方程式是。
(4)将0.23和0.11
氧气放入容积为1
的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12
,则反应的平衡常数
。若温度不变,再加入0.50
氧气后重新达到平衡,则
的平衡浓度(填"增大"、"不变"或"减小"),氧气的转化率(填"升高"、"不变"或"降低"),
的体积分数(填"增大"、"不变"或"减小")。
、
、
、
、
、
、
、
、
是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:
①、
、
、
、
能使湿润的蓝色石蕊试纸变红,
能使湿润的红色石蕊试纸变蓝,
、
、
不能使湿润的石蕊试纸变色;
②和
相遇产生白色烟雾;
③和
都能使品红溶液褪色;
④将红热的铜丝放入装有的瓶中,瓶内充满棕黄色的烟;
⑤将点燃的镁条放入装有的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
⑥和
相遇生成红棕色气体;
⑦G在中燃烧可以产生
和
;
⑧将和
在瓶中混合后于亮处放置几分钟,瓶内壁出现油状液滴并产生
。
回答下列问题:
(1)的化学式是,②中烟雾的化学式是;
(2)④中发生反应的化学方程式是 ;
;
(3)⑤中发生反应的化学方程式是;
(4)的化学式是,
的化学式是;
(5)⑦中发生反应的化学方程式是;
(6)的化学式是。
有下列转代关系:
(1)若C是可用来自来水消毒的气体,D、E是氧化物,D能化为E时增加氧的质量是总质量的25.8%,则A是 (写化学式)并写出A在一定条件下生成的C的化学方程式 。
(2)若E是酸酐,且为无色易挥发的晶体,A为气态氢化物,则A与D反应生成B的化学方程式为 。
(3)若C是水,B是无氧化合物,且在同系物中是相对分子质量最小的化合物;E能使紫色石蕊试液显红色,则A的结构简式为 。A、B、D、E中易溶于水的是 。(写结构简式)
(4)写出(3)中下列反应的化学方程式,注明反应类型:
D→E 反应类型为__________。
现有下列短周期元素性质的数据:
| 元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
| 原子半径 |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
| 最高或 最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
| -2 |
|
|
-3 |
-1 |
|
-3 |
|
下列说法正确的是:
| A.元素④的原子序数小于元素⑦的原子序数 |
| B.②、③处于同一周期 |
| C.上述八种元素最高价氧化物对应的水化物,⑤号酸性最强 |
D.⑧号元素原子结构示意图为: |
下表列出了①〜⑥六种元素在周期表中的位置:
   族 族周期 |
ⅠA |
  |
0 |
|||||
| 1 |
|
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
|
请按要求回答下列问题。
(1)写出下列标号元素的元素符号:① ⑤ ;
(2)元素②的最高价氧化物对应水化物的分子式为 ;
(3)元素③所形成的两种氢化物的分子式分别为 和 ;
(4)元素④的氯化物的电子式为 ;
物质的转化关系如下图所示(有的反庆可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
(1)若A为黄色固体,C能使品红试液褪色,D的水溶液中加入 酸化的
酸化的 溶液有白色沉淀生成。则
溶液有白色沉淀生成。则
①工业上反应I在________________中进行,反应Ⅱ在_____________(均填设备名称)中进行。工业上反应Ⅲ用于吸收E的试剂是____________。
②由两种单质直接化合得到甲的反应条件是____________或________________。
③反应I的化学方程式是_______________________________。
④D和乙反应的离子方程式是___________________________________。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。
则①甲的电子式是________________________。
②D的溶液与乙反应的离子方程式是____________________________。
③若1.7g A与 反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:___________________________________。
反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:___________________________________。
甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如图所示,又知:
①甲、乙、丙均为前三周期元素的单质,常温下均为气态,
丁是日常生活中的一种常见金属;
②常温下,X是无色液体,Y是黑色固体;
③丙在乙中燃烧发出苍白色的火焰,丁在乙中燃烧生成棕黄色
的烟,W的水溶液呈黄色。
回答下列问题:
(1) 写出下列物质的化学式: X W
(2)将乙单质通入紫色石蕊试液中,看到的现象是 。
(3)写出丁单质与Z的水溶液反应的化学方程式 。
(本题共14分)
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
(1)A、B、C、D、E、F六种物质中的含有同一种元素在周期表中位置 ,
(2)写出检验D溶液中阳离子的方法 。
(3)写出反应④的离子方程式 。
(4)若28gA单质在足量的氧气中灼烧,反应放出的热量为QkJ(Q>0),写出这个反应的热化学方程式: ;
(5)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH 7
(填“>”、“<”或“=”),用离子方程式表示其原因: ;若向气体K的0.1mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中含各离子物质的质量浓度由大到小的关系是 。
(本题共12分)
以海水中常见物质A为原料可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据物质之间的转化关系回答下列问题:
(1)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为 ;
(2)写出电解A溶液的化学方程式为 ;
(3)若使工业合成J反应的平衡向生成J的方向移动,可采取的措施有 (填字母代号);
A.升高温度 B.增大压强 C.使用催化剂 D.液化分离
(4)将F和J通入A的饱合溶液中的顺序为 。
A.先通入F后通入J B.先通入J后通入F
C.同时通入 D.没有先后顺序要求
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中
NaCl的质量分数。



样品mg 溶液 沉淀 固体ng
①检验沉淀是否洗涤干净的所用到的试剂是: ,
②样品中NaCl的质量分数的数学表达式为: 。
(8分) A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
(1)若B是一种易溶于水,且能使品红溶液褪色的无色气体,则B→C的化学方程式为 。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为 ,试写出C与水反应的化学方程式 。
(3)若C是红棕色气体,试写出B与氧气反应的化学方程式 。
有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且原子半径B>C;
②D、E、G是非金属元素,它们都可以跟氢化合生成气态氢化物HD、HE和HG,在室温时,G的单质与氢气暗处混合就爆炸,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体。
(1)A的名称是 ,B位于周期表中第 周期 族,C的原子结构示意图是
(每空l分)。
(2)E的单质颜色是 。
(3)A元素与D元素形成化合物的电子式是 。
(4)G的单质与水反应的化学方程式是 。
(5)F的元素符号是 。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 ,酸性最强的化学式是 ,气态氢化物最稳定的化学式是 (每空l分)。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是
。
(15分)
阅读分析材料,据此完成下列要求 A到N为中学化学常见物质或该物质的水溶液,且它们之间存在如下转化关系
A到N为中学化学常见物质或该物质的水溶液,且它们之间存在如下转化关系
其中,A是生活的必需品,其焰色反应呈黄色;B为二元强酸;D为氢化物;E在地壳中的含量居第三位,其单质大量用于制造导线和合金;J是普通干电池的重要成分;C为酸式盐;F的水溶液与少量的过氧化钠反应也可得到I;G是一种不溶于稀硝酸的白色沉淀;M在L气体中燃烧产生棕黄色烟。
⑴A的晶体类型为 ,C的化学式为 。
⑵M的化学式为 ;若N的水溶液呈蓝绿色,则M与B反应的化学方程
式为: 。
⑶D的浓溶液与J反应的离子方程式为: 。F的水溶液与过量的过氧化钠反应的离子方程式为: 。
⑷H溶液中各离子浓度由小到大的顺序为 。
(15分)阅读分析材料,据此完成下列要求
短周期元素A、B、C、D、E、F,它们的原子序数依次增大,其中B和C为同一周期;D、E、F为同一周期;A和D、C和F分别为同一主族;C元素原子的最外层电子数是次外层电子数的3倍;D是所在周期原子半径最大的元素(除稀有气体外);E是非金属元素,其单质在电子工业中有重要用处。
⑴A元素与碳元素按质量比1:3可以形成化合物X,将C2、X和23.4gD2C2置于密闭容器中,用电火花引起化学反应,反应结束后,容器内的气压为零(250℃),将残留物溶于水中,无气体产生,则C2与X的物质的量之比为 。根据其反应方程式分析,若反应中有4mol电子转移,则消耗C2的物质的量为 mol。
⑵工业上生产单质E的化学方程式为: ;指出E的氧化物在通讯中的一种用途 。
⑶一定条件下,A2气体与B2气体充分反应可生成6.8g空间构型三角锥形的气体,放出18.44kJ热量,则该反应的热化学方程式为为: ;A与B按原子个数比1:2可形成相对原子质量为32的化合物,写出该化合物与足量盐酸反应的离子方程式 。
⑷A2与C2在KOH的浓溶液中可以形成原电池。如果以Pt为电极,在电池的两极分别通入A2和C2,则通入的A2一极的电极反应式为: 。
⑸在10L的密闭容器中,通入2molFC2和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.21mol/L,则平衡时FC2的转化率为 。
下图转化关系中,A、B、C、D、E都是短周期元素的单质,在常温常压下A是固体,其余都是气体,且C呈黄绿色。化合物H和I两种气体相遇时产生白烟K(NH4Cl)。化合物G的焰色反应为黄色,B为氧气。反应①和②均在溶液中进行。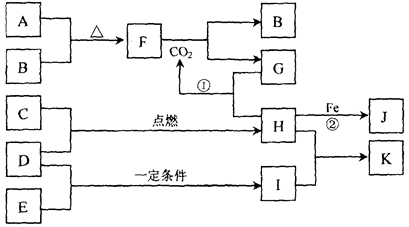
请按要求回答下列问题。
(1)写出下列物质的化学式:D 、F 。
(2)反应②的离子方程式为 。
(3)向K溶液中加入硝酸酸化的硝酸银溶液,反应的现象为 。
(4)将少量单质C通入盛有淀粉KI溶液的试管中,液体变为蓝色。这说明单质C的氧化性 于单质碘(填“强”或“弱”)。
(5)向J溶液中滴入NaOH溶液时,生成的灰白色沉淀迅速变成灰绿色,最后变成
红褐色。写出红褐色沉淀的化学式: 。
A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应。A、B元素的离子结构和Ne具有相同的电子层排布;5.8 g B的氢氧化物恰好能与100 mL 2 mol·L—1盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。 C的最高价氧化物的水化物是所有含氧酸中酸性最强的;D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍。根据上述条件回答:
(1)元素C位于第__________周期第__________族,它的最高价氧化物的水化物的化学式为____________。
(2)A元素是_______,B元素是______,D元素是______。(写元素符号)
(3)A与D形成的原子个数比为2:1的化合物的化学式是___ _ ____,
用电子式表示它的形成过程
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,
其离子方程式为______________________________ __________________。