铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装饰材料,主要用于制作窗框、卷帘门、防护栏等,下列与这些用途无关的性质是
| A.不易生锈 | B.导电性好 | C.密度小 | D.强度高 |
医生建议患甲状腺肿大的病人多食海带,这是由于海带中含有丰富的 ;
碘缺乏病是目前已知的导致人类智力障碍的主要原因。为解决这一全国性的问题,我国已经开始实施“智力工程”,最经济的可行措施是 。
在下图装置中,烧瓶中充满干燥气体A,将滴管中的液体B挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶。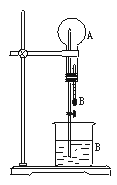
(1)若A为HCl气体,B为石蕊试液,则形成红色的喷泉。试分析红色喷泉形成的原因。
(2)请你根据喷泉形成的原理,选择适当的A和B来完成喷泉实验(至少通过三种途径且其中一种喷泉为有色)。将你的选择填入下表。
| |
A |
B |
喷泉颜色 |
| 途径1 |
|
|
|
| 途径2 |
|
|
|
| 途径3 |
|
|
|
(3)已知气体压强p、体积V、温度T、物质的量n之间的关系可用克拉珀龙方程式表示:pV=nRT(R为常数).你能否根据此关系再找出能够完成喷泉实验的其他条件?
碘缺乏症遍及全球,多发生于山区。南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等10余省的山区发病率也较高。据估计我国患者大约有1000万人。为控制该病的发生,较为有效的方法是食用含碘食盐,我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3)。据此回答下列问题:
(1)碘是合成下列哪种激素的主要原料之一
A.胰岛素 B.甲状腺激素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患
A.甲状腺亢进 B.佝偻病 C.地方性甲状腺肿 D.糖尿病
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾。反应的化学方程式为 。氧化产物与还原产物的物质的量之比为 。能观察到的明显现象是 。
(4)已知KIO3可用电解方法制得。总反应化学方程式为:KI+3H2O KIO3+3H2↑。在某温度下.若以12 A的电流强度电解KI溶液10 min.理论上可得标况下氢气___________L。
KIO3+3H2↑。在某温度下.若以12 A的电流强度电解KI溶液10 min.理论上可得标况下氢气___________L。
(1)一种变色眼镜的镜片和普通照相感光胶片中含有卤化银。镜片变化是因为卤化银在光的作用下发生化学反应,其反应式是 ,照相感光胶片曝光的化学反应是
。
(2)在我国干旱严重的华北地区,近年来利用飞机、高炮或火箭等运载工具向过冷支层中播撒碘化银(AgI)或干冰,实现人工增雨(或人工增雪),达到减灾的目的。下列有关人工增雨的评述中,你认为不甚理智的是
| A.它对农业生产条件和大气环境的改善有一定的效益 |
| B.它使用的碘化银中的重金属元素对土壤造成污染 |
| C.它使用的AgI如换成干冰,可避免重金属元素对土壤的污染 |
| D.它是人类彻底战胜自然的表现,体现了人类的力量是无穷的 |
向溴水中加入下列物质.不能使溴水的颜色变为无色的是
| A.加入CCl4多次萃取 |
| B.加入适量KI溶液 |
| C.加入适量的镁粉 |
| D.加入适量的K2CO3溶液 |
化学上将SCN-、OCN-、CN-等离子称为“类卤离子”。现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成红色。将此红色溶液分成两份:一份中加入KMnO4溶液,红色褪去;(1)向另一份中通入SO2时,红色也消失;(2)再滴加少量KMnO4溶液,其紫色也褪去。(3)试用离子方程式解释以上三部分颜色变化的原因(方程式可以不配平)。
向NaBr、NaI、Na2SO3混和液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到的固体剩余物质的组成可能是
| A.NaCl、Na2SO4 | B.NaCl、NaBr、Na2SO4 |
| C.NaCl、Na2SO4、I2 | D.NaCl、NaI、Na2SO4 |
有8 g Na2O2、Na2O、Na2CO3、NaOH的混合物与200 g质量分数为3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为
| A.8 g | B.15.5 g | C.11.7 g | D.无法计算 |
仔细阅读下图,已知B、D、E、F、G是氧化物,F、K是氢化物;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)。
请按要求回答:
(1)反应①既是分解反应,又是氧化还原反应,产物B、D、E、F的物质的量之比1:1:1:14。A强热分解的化学反应方程式为 。
(2)写出反应②在工业生产上的一种用途: 。
(3)反应③的离子方程式为 ;
反应④的化学方程式为 。
(4)常以C或H制成容器盛装和运输I的浓溶液,其原理是
。
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4==2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3==2Na2SO4+3NaHSO4+H2O+I2
下列有关说法正确的是
| A.NaI和NaIO3在一定条件下能反应生成I2 |
| B.I2在反应①中是还原产物,在反应②中是氧化产物 |
| C.两个反应中生成等量的I2时转移的电子数相等 |
D.氧化性:MnO2>IO >I2>SO >I2>SO >Mn2+ >Mn2+ |
 有关物质存在如图所示的转化关系(部分产物已省略)。通常
有关物质存在如图所示的转化关系(部分产物已省略)。通常为气体单质,
为紫黑色固体单质。实验室中,常用固体
在
的催化下加热制取气体单质
。




 请回答下列问题:
请回答下列问题:
 (1)反应①的化学方程式为
(1)反应①的化学方程式为
 (2)反应②的离子方程式为
(2)反应②的离子方程式为
(3)写出另外一种实验室制取的化学方程式
 (4)
(4)溶液与
溶液混合可形成沉淀,此沉淀的
=7.0×10-9。将等体积的
溶液与
溶液混合,若
的浓度为1×10-2
,则生成沉淀所需
溶液的最小浓度为。