下图是向MgCl2、AlCl3混合溶液中加入a或b时,沉淀的物质的量y(mol)与加入的a或b的体积x(mL)的关系图,以下结论不正确的是( )
| A.混合溶液中c(AlCl3)∶c(MgCl2)=1∶1 |
| B.c(AlCl3)∶c(MgCl2)=3∶1 |
| C.t之前加NaOH溶液,t之后加盐酸 |
| D.盐酸与NaOH溶液的物质的量的浓度相同 |
下列除杂质的方法不可行的是
| A.用过量氨水除去Al3+溶液中的少量Fe3+ |
| B.将混合气体通过灼热的铜网除去N2中的少量O2 |
| C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 |
| D.用盐酸除去AgCl中少量的Ag2CO3 |
把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中的金属离子
| A.是Fe3+和Cu2+ | B.是Fe2+和Cu2+ | C.是Fe3+和Fe2+ | D.只有Fe2+ |
工业上制造金刚砂(SiC)的化学方程式为SiO2+3C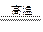 SiC+2CO↑。在这个氧化还原反应中,氧化剂与还原剂的物质的量之比是
SiC+2CO↑。在这个氧化还原反应中,氧化剂与还原剂的物质的量之比是
A.1∶2 B.2∶1 C.1∶1 D.3∶5
普通玻璃中含13%的Na2O,11.7%的CaO,75.3%的SiO2。用氧化物的形式表示普通玻璃组成的化学式是
| A.Na2O·2CaO·6SiO2 |
| B.2Na2O·CaO·6SiO2 |
| C.Na2O·CaO·6SiO2 |
| D.Na2O·2CaO·SiO2 |
下列说法正确的是
A.地壳中碳的含量居第一位
B.地壳中硅的含量居第二位
C.自然界中存在天然C单质,不存在天然Si单质
D.C、Si都能与强碱溶液反应,并放出H2
向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,并放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是
| A.11.2 g | B.5.6 g | C.2.8 g | D.无法计算 |
有一种碘的氯化物可以称为碘酸碘,其中碘元素呈+3、+5两种价态,则这种化合物的化学式是( )
| A.I2O4 | B.I3O5 | C.I4O7 | D.I4O9 |
用干燥的高锰酸钾可以制得极纯而干燥的氧气:KMnO4→MnO2+K2O+O2(240 ℃)。下列说法不正确的是( )
| A.每生成16 g氧气转移4 mol电子 |
| B.相同质量的KMnO4分解,生成MnO2的反应比生成K2MnO4的反应放出更多氧气 |
| C.O2是氧化产物,MnO2是还原产物 |
| D.在此条件下,KMnO4的氧化性强于O2 |
除去Na2CO3固体中少量NaHCO3的最佳方法是( )
| A.加入适量盐酸 |
| B.加入NaOH溶液 |
| C.加热 |
| D.配成溶液后通入CO2 |
氯化溴是由两种卤素互相结合而成的卤素化合物,其化学性质与Cl2相似,能与金属和非金属反应生成卤化物,能与水反应:BrCl+H2O====HBrO+HCl,下列有关BrCl的性质的叙述中不正确的是( )
| A.是较强的氧化剂 |
| B.是一种化合物 |
| C.能使湿润的淀粉碘化钾试纸变蓝 |
| D.BrCl与水反应,BrCl既是氧化剂又是还原剂 |
实验室制Cl2的反应为4HCl(浓)+MnO2 MnCl2+C12↑+2H2O。下列说法错误的是
MnCl2+C12↑+2H2O。下列说法错误的是
| A.还原剂是HCl,氧化剂是MnO2 |
| B.每生成1 mol Cl2,转移电子的物质的量为2 mol |
| C.每消耗1 mol MnO2,起还原剂作用的HCl消耗4 mol |
| D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |