某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特性。它是以中学化学中常见物质为原料来生产的,图中C、M、K均含A元素,M的分子式为A(NH2)4;E为不含A 元素的氢化物,在空气中易形成白雾;G、F均为难溶于水的白色沉淀,H为氧化物,J为气体;其余物质均为中学化学中常见物质。(提示:NH3和H2O的化学性质在某些方面相似)

请回答下列问题:
(1)写出指定物质的化学式:A ,C ,F 。
(2)K的化学式为 。
(3)写出图中下列序号的化学方程式:
反应④ ;
反应⑤ 。
(4)写出图中反应⑥的离子方程式: 。
某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
(1)写出用惰性电极电解M溶液的离子方程式__________。写出F的电子式___________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是______________。
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图所示,“则A与B溶液”反应后溶液中的溶质化学式为________。
(4)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是______________.
已知D、M、H是常见得非金属单质,其中M是无色气体,H是有色气体。J是一种金属单质(其同族的某种元素是形成化合物种类最多的元素),A、C是金属氧化物,C和J均是某种常见电池的电极材料,J元素的+2价化合物比+4价化合物稳定,B与C反应时,每生成1molH同时消耗4molB和1molC。K只知含有CO或CO2中的一种或两种。它们关系如下图所示:
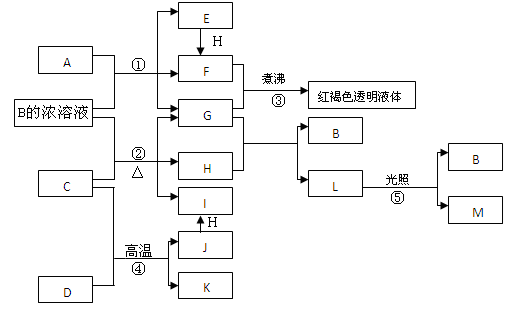
(1)写出A物质中所含金属元素在周期表中的位置:_________________。
(2)写出化合物L的电子式:______________ 反应②的化学方程式为_________________。
(3)向图中的红褐色透明液体中逐滴滴入HI溶液,可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,红褐色沉淀溶解的离子方程式为_______________。
(4)由金属氧化物A和C得到其相应的金属,在冶金工业上一般可用_______________(填序号)方法
①热还原法 ②电解法 ③热分解法
其中从A得到其相应金属也可用铝热法,若反应中1molA参加反应,转移电子的物质的量为________mol。
(5)用C、J作电极,与硫酸构成如图所示原电池,负极的电极反应为__________,当反应转移2mol电子时,负极质量增加______克。

如图中A到F是化合物,且A、B、E、F均含钠元素,G是单质.
(1)写出A、B、E、F的化学式:A ________,B________,E________,F________.
(2)写出反应①②③的化学方程式:
①______________________________________;
②______________________________________;
③______________________________________。
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:
(1)若常温下A为有色气体。
①当F是一种金属单质时,请写出一定浓度的B溶液和适量F反应生成C与气体E的离子方程式:_________________。
②当C为直线形分子时,E具有漂白性,物质F焰色反应呈黄色,则C的电子式为________________;D中所含化学键的类型为____________________。
(2)若A为淡黄色固体,D为白色难溶于水的物质,且A和D的相对分子质量相等,请用离子方程式表示F的水溶液呈酸性的原因:_________________。
(3)若A中一种元素原子的最外层电子数为内层电子总数的 ,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:____________;B转化为C的化学方程式为______________。
,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:____________;B转化为C的化学方程式为______________。
V、W、X、Y、Z是由四种短周期元素中的两种或三种组成的5种化合物,其中W、X、Z均由两种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素和两种非金属元素组成,其原子个数比为1︰3︰9,所含原子总数等于其组成中金属元素的原子序数。它们之间的反应关系如下图:

(1)写出W物质的一种用途 。
(2)写出V与足量NaOH溶液反应的化学方程式 。
(3)将过量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为 。
(4)4 g Z完全燃烧生成X和液态水放出222.5 kJ的热量,请写出表示Z燃烧热的热化学方程式 。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48 L X气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是 。
(6)Y是一种难溶物质,其溶度积常数为1.25×10-33。将0.01 mol Y投入1 L某浓度的盐酸中,为使Y完全溶解得到澄清透明溶液,则盐酸的浓度至少应为 (体积变化忽略不计,结果保留三位有效数字)。
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738 kJ·mol-1 I2=1451 kJ·mol-1 I3=7733 kJ·mol-1 I4=10540 kJ·mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式:______________________________。
(2)B元素基态原子中能量最高的电子,其电子云在空间有__________个方向,原子轨道呈_______形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为 该同学所画的电子排布图违背___________________。
该同学所画的电子排布图违背___________________。
(4)G位于________族________区,该元素的核外电子排布式为_________________。
(5)DE3中心原子的杂化方式为____________,用价层电子对互斥理论推测其空间构型为__________。
(6)检验F元素的方法是____________,请用原子结构的知识解释产生此现象的原因:_____________。
I.甲、乙、丙三种物质之间有如下转化关系:

甲和丙都是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液.
(1)则甲是______,丙是________(填化学式)。
(2)写出“ ”转化的离子方程式:__________。
”转化的离子方程式:__________。
II.右图表示A——E 五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物。
(1)写出③、⑧的化学方程式:③______________; ⑧_____________________.
(2)写出反应④的离子方程式:___________________。

某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
(1)写出用惰性电极电解M溶液的离子方程式__________。写出F的电子式___________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是______________。
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图所示,“则A与B溶液”反应后溶液中的溶质化学式为________。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_______________。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式是_____________
(6)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是________________。
(7)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其浓度之比为_______________________。
A、B、D、R、Q五种短周期主族元素,其原子序数依次增大,其中A原子核内无中子,B与D同周期,R与Q同周期,A与R同主族,D与Q同主族,D元素的原子最外层电子数是次外层电子数的三倍,B元素的最高正价和最低负价代数和为2。请用对应的化学用语回答下列问题:
(1)Q元素位于元素周期表中第______周期_____族。
(2)D、R、Q三种元素形成的简单离子的半径由大到小的顺序是________(用离子符号表示)。
(3)由A、B两种元素以原子个数比为5:1形成的离子化合物X,X的电子式为_______。
(4)由A、B元素形成的A2B4可以与O2、KOH溶液形成原电池,该原电池负极的电极反应式为____。
(5)由A、D、R、Q四种元素形成的化合物Y(RAQD3)(已知A2QD3的Ka1=1.2×10-2、Ka2=6.3×10-8),则Y溶液中各离子浓度由大到小的顺序为_______________;室温下,向Y溶液中加入一定量的NaOH,使溶液中c(AQD3-)=c(QD32-),则此时溶液呈______(填“酸性”、“碱性”或“中性”)
(6)Fe与D元素可形成Fe2D3、Fe3D4等化合物。向5.2g Fe2D3、Fe3D4、Cu的混合中加入0.5mol/L的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为______g。
下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。

试回答下列问题:
(1)写出无色溶液中溶质的化学式: ;写出E的电子式 。
(2)写出C到白色沉淀的化学方程式是 。
(3)反应F→D的离子方程式是 。
有A、B、C、D四种化合物,分别由K+、Ba2+、SO 、CO
、CO 、OH-中两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水但溶于盐酸并放出无色无味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
、OH-中两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水但溶于盐酸并放出无色无味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断A、B、C、D、E的化学式。
A ;B ;C ;D ;E ;
(2)写出下列反应的离子方程式。
D与硫酸反应 。
B与盐酸反应 ;
C与硫酸反应 ;
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置_________。
(2)写出反应①、⑤、⑥的化学方程式和反应④的离子方程式。
反应①:________________。
反应⑤:________________。
反应⑥:________________。
反应④:________________。
(3)从能量变化的角度看,①、②、③反应中,ΔH<0的是_______(填序号)。
已知下列各物质都是由短周期元素组成,它们之间的关系如下图所示:

常温下,A、F为金属单质,F既能与L溶液反应,又能与N溶液反应。C、H、M为气体单质,其中H呈黄绿色,A、B、I、K、L、R焰色反应均为黄色。请回答:
(1)P的结构式为 ,B的电子式为 。
(2)R的水溶液呈碱性的原因可用离子方程式表示为 。
(3)还有一种物质能与B反应生成C,写出这个反应的化学方程式 。
(4)还有一种单质能与J反应生成C,写出这个反应的化学方程式 。
(5)某气体Q具有漂白作用,将Q与H等物质的量通入水中所得溶液没有漂白作用,写出该过程中发生反应的离子方程式______________。