已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,则反应②的离子方程式是________________________。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为________________________________。
(3)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为______________。某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:________________。
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答下列问题: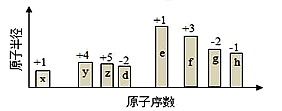
(1)f 在元素周期表的位置是__________。
(2)比较y、g、h最高价氧化物对应水化物的酸性强弱是:_______>________>_______。(用化学式表示)
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,其电子式为__________;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为____________。(填序号)
| A.MnO2 | B.FeCl3 | C.Na2SO3 | D.KMnO4 |
 (4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: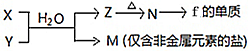
①
 X溶液与Y溶液反应的离子方程式为__________________________
X溶液与Y溶液反应的离子方程式为__________________________
②常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至________________
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1mol·L-1 R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀的物质的量随NaOH溶液体积变化如图所示: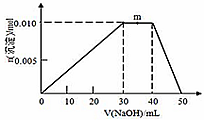
①写出m点反应的离子方程式____________。
②若R溶液中改加20mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____________mol。
有关物质的转化关系如下图所示(部分物质和条件已略去)。A、C、E、G是中学化学中的常见单质,A为黑色粉末,G为黄绿色气体,E在G 中燃烧时发出苍白色火焰,F的焰色反应显黄色,B是常见的无色液体,K为红褐色沉淀。

请回答下列问题:
(1)G的化学式为 ,F的化学式为 。
(2)D、B、H混和生成J和I的离子方程式: 。
(3)常温下G与F的溶液反应的离子方程式:
(4)J转变为I的化学方程式:
A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图所示的关系,完成下列空白:
(1)向酚酞试液中加入化合物A的粉末,现象为_________________________。
(2)单质甲与化合物B反应的离子方程式为________________________5.05g单质甲-钾合金溶于200mL水生成0.075mol氢气,确定该合金的化学式为________________。
(3)向50mL某浓度的化合物C的溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体体积V(CO2)与加入盐酸的体积 V(HCl)的关系有下列图示两种情况。
①由A确定滴加前60mL的盐酸时,发生反应的离子方程式____________________。 (有几个写几个) 。
②由A图表明,原溶液通入CO2气体后,所得溶液中的溶质的化学式为___________。
③原化合物C溶液的物质的量浓度为____________________。
④由A、B可知,两次实验通入的CO2的体积比为__________。
如图中A到F是化合物,且A、B、E、F均含钠元素,G是单质.
(1)写出A、B、E、F的化学式:A ________,B________,E________,F________.
(2)写出反应①②③的化学方程式:
①______________________________________;
②______________________________________;
③______________________________________。
A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀。请填写下列空白:

(1)A、B、C、D、E、F六种物质中所含的同一种元素是___________(写元素符号)。
(2)写出物质C、G的化学式:C___________,G___________。
(3)反应①的反应类型是: (填基本反应类型)。
(4)反应④的离子方程式: 。
(5)检验溶液D中金属阳离子的常用方法是: 。
A、B、C、D、E是中学常见的几种化合物,相关物质间的关系如下图所示:

已知:X、Y是生活中常见的金属单质,A、B都是氧化物且A是红棕色粉末。
回答下列问题:
(1)单质X与A反应的化学方程式是________________________________;
(2)若试剂1和试剂2均是强电解质。
①若试剂1和试剂2的酸碱性相同,则C溶液显 (填“酸性”、“碱性”或“中性”);
②若试剂1和试剂2的酸碱性不同,试剂1和B的离子方程式是 。
(3)若试剂2是稀硝酸。
①Y单质与稀硝酸反应生成E时,Y单质必须过量,写出该反应的离子方程式 。如果稀硝酸过量,可以选择试剂 进行验证。
②D的阳离子能够与强碱、氯气反应,生成一种高效的净水剂YO42-,写出有关反应的离子方程式 。
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
(1)X的单质与A反应的反应方程式是______________________。
(2)B物质的用途为__________________________________(写出一条)。
(3)若试剂1是NaOH溶液,试剂2为盐酸,则将D的饱和溶液滴加到沸水中加热至溶液为红褐色时,发生的离子反应方程式为___________________________。
(4)若试剂1和试剂2均是稀硫酸:
① 将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)__________________。
②某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是__________________。
已知有以下物质相互转化

试回答:
(1)写出B的化学式 C的化学式 D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)把KSCN加到G溶液中的现象是 ;向G溶液加入A的有关离子反应方程式 _______。
(4) 焰色反应是 (填物理或化学)变化,经过焰色反应试验后的铂丝可选择下面 (填字母)试剂清洗。 A 硫酸 B 盐酸 C 硝酸
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色, A、B、C、D之间有如下图所示的转化关系:
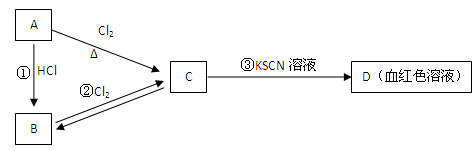
试回答下列问题:
(1)A是 ,C是 (填化学式)
(2)B的溶液与NaOH溶液混合的现象是
相应的化学方程为 、 。
(3)反应①的反应类型是 反应(选填“化合”、“分解”、“置换” “复分解”)。
(4)写出反应②的离子方程式 。
(Ⅰ)A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题。

(1)已知常温下A为有色气体。若F是一种金属单质,写出B和适量F反应生成C与气体E的离子方程式_______________________;
(2)若A为双原子分子,C为直线型分子,E具有漂白性,物质F焰色反应呈黄色.则F的化学式为_____________________。
(3)若A为淡黄色固体,则A与水反应的化学方程式为_________________。
①若物质B和D的式量相等,D为淡黄色固体物质,C的大量排放往往会造成严重的环境问题即_______________。C与F反应的化学方程式为________________;
②若物质A和D的式量相等,D为白色絮状沉淀,写出C与F反应的离子方程式_________________________。
(Ⅱ)亚磷酸(H3PO3)是二元弱酸,与足量NaOH溶液反应,生成Na2HPO3。
(1)根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7(填“>”“<”或“=”)。常温下,向10mL0.01 mol·L-1H3PO3溶液中滴加10mL0.02 mol·L-1NaOH溶液后,溶液中各种离子浓度由大到小的顺序是_________ ;
(2)亚磷酸具有强还原性,可将Cu2+还原为金属单质,亚磷酸与硫酸铜溶液反应的方程式为______.
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y2是空气主要成分之一。请回答:
(1)Q元素在周期表中的位置_______________________;
(2)这五种元素原子半径从大到小的顺序为_______________________(填元素符号)
(3)元素的非金属性Z_________Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有___________(填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与它的低价氧化物反应的化学方程式为_____________________
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式____________;实验室制备气体A的化学方程式 B的水溶液不呈中性的原因___________________(用离子方程式表示)
(6)若使A按下列途径完全转化为F:

①F的化学式为_____________;
②C→F过程中氧化剂与还原剂的物质的量之比为_____________。
A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、 Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol/L A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断A-E的化学式:
A 、B 、C 、E
(2)写出①A溶液呈碱性和③的离子方程式:
①
③ _
下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,Z是常见的一种无色液体,E是酸。当X无论是强酸还是强碱时,都有如下转化关系:当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素.回答下列问题:

(1)A是_ ,Y是 ,Z是 .
(2)当X是强酸时,E是 ,写出B生成C的化学方程式
(3)当X是强碱时,E是 ,写出B生成C的化学方程式
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、红褐色沉淀H,已知黄绿色气体乙为Cl2,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出),请根据以上信息回答下列问题:

(1)写出下列物质的化学式
B________ C_______G 丙
(2)一小块A放在坩埚里,加热,写出该反应的化学方程式: ;
B的氧化物与D反应的离子方程式 ;反应⑥的离子方程式 ;
无机非金属材料的主角I的单质也能与物质D反应有甲生成,试着写出该反应的化学方程式 ;
反应④中氧化剂与还原剂物质的量之比为 。
(3)物质G的溶液中加入NH4SCN溶液,现象______________________,写出该反应的离子方程式 。