实验室可以通过三条途径来制取氮气:
①加热条件下用NH3还原CuO制得纯净的N2和活性铜粉,反应的化学方程式为:
② 将空气通过灼热的活性铜粉制得较纯净的N2
③ 加热NaNO2(有毒性)与NH4Cl的混合浓溶液制取N2,反应的化学方程式为:
按上述途径制N2可供选择的实验仪器如下图所示,其他必要的仪器如铁架台、铁夹、铁圈、石棉网、酒精灯等未列出。
(l)按途径 ① 制取N2时所需的氨气要用浓氨水与生石灰作原料制取,化学方程式为: ,最好要用上述仪器中 的(填仪器字母,下同)作为氨气发生装置。要制取并收集纯净的N2(允许含少量的水蒸气),还应使用到上述仪器中的
,最好要用上述仪器中 的(填仪器字母,下同)作为氨气发生装置。要制取并收集纯净的N2(允许含少量的水蒸气),还应使用到上述仪器中的
(2) ① 和 ② 两种途径常常被协同使用。这种方法与途径 ③ 相比优点是
(3)检查 E 装置气密性的方法是 。利用 E 装置还可以制取的气体有 (写出三种)。
取化学式为MZ的黄色粉末状化合物进行如下实验。将MZ和足量碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水,按图连接仪器。

实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成。同时,b瓶的溶液中出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却。此时,管中的熔融触物凝固成银白色金属。根据以上叙述回答问题:
(1)元素Z是 。
(2)停止加热前是否需要先断开a和b的连接处?为什么?
;
(3)反应管a中发生的所有反应的化学方程式是 ;
(4)本实验的尾气是否需处理?如需处理,请回答如何处理:如不需处理,请说明理由。
。
我们用字母L、M、Q、R、X分别代表五种含不同化合价的氮元素的物质,并且每种物质中氮元素的化合价只有一种。又知道物质L中氮元素的化合价要比物质M中氮元素的化合价低,并且在一定条件下,它们会有如下的相互转换关系(未配平):
①Q+HCl→M+Cl2;
②R+L→X+H2O;
③R+O2→L+H2O.
(1)已知这五种物质中有一种是硝酸,那么硝酸应该是L、M、Q、R、X中的________(填字母),判断的依据是_________________________________________________。
(2)反应③是在催化剂(如铂、氧化铁等)存在,并且加热到一定温度时发生的,这个反应在工业上有重要的应用。请据此推断,若物质X是密度比CO2密度小的气体,那么X的化学式是__________.
(3)某同学写出下面三个不同价态的氮的化合物相互转换的关系(未配平):
a、NO+HNO3→N2O3+H2O
b、NH3+NO→HNO2+H2O
c、N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是________________________________(填编号).
盐酸、硫酸和硝酸是三种重要的酸。
(1)工业上生产盐酸与硝酸时,都要用到的气态反应物是_______;
(2)工业上生产硫酸与硝酸时,用到的相同的重要设备是_______;
(3)工业生产中欲制得高浓度的硫酸与硝酸,可使用的相同物质是_______;
(4)浓盐酸与浓硝酸暴露在空气中,相同的现象是_______;
(5)浓硫酸与浓硝酸都可用铁、铝容器贮存的相同原理是_______;
(6)实验室制备H2、CO2、H2S、SO2时,用盐酸和浓硫酸可制备的相同气体是_______。
NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点。NO亦被称为“明星分子”。请回答下列问题。
(1)NO对环境的危害在于_________(填编号)。
| A.破坏臭氧层 | B.高温下能使一些金属被氧化 | C.造成酸雨 | D.与人体血红蛋白结合 |
(2)在含Cu+(亚铜离子)的酶的活化中心,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式______________________________________
(3)在常温下,把NO气体压缩到100大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式_________________.
(4)解释变化(3)中为什么最后气体总压力小于原压力的2/3?__________________________.
(5)NO成为“臭名昭著的明星分子”所包含的哲学原理是_____________________________
“神舟”5号宇宙飞船是靠长征Ⅱ(F)型运载火箭发射升空的。该火箭所用的燃料是偏二甲肼〔(CH3)2N—NH2〕,氧化剂是N2O4,产物是氮气、二氧化碳和水。
(1)火箭点火瞬间,逸出的红棕色气体是_______,产生该气体的化学反应方程式为_________。
(2)偏二甲肼在N2O4中燃烧的化学方程式为_________________________,当有1 mol偏二甲肼燃烧时,转移电子的物质的量为___________。
锌与硝酸反应,若有1mol硝酸参加法院,则有0.8mol的电子发生转移,此时硝酸的还原产物中N元素的化合价 。
、将VmLNO和NO2的混合气体通过水吸收后,得到amL无色气体A。将此无色气体A与等体积的O2混合,再通过水充分吸收后,收集到5mL无色气体B。试回答:
⑴气体A是① ;气体B是② 。
⑵A气体的体积是③ 毫升。
检验试管中盛有的少量白色固体是铵盐的方法是
| A.将固体加热,用湿润的红色石蕊试纸在试管口检验,看是否变蓝 |
| B.加水溶解,用pH试纸测溶液的酸碱性 |
| C.加入NaOH溶液,加热,再滴入酚酞试液 |
| D.加入NaOH溶液,加热,用湿润的红色石蕊试纸在试管口检验,看是否变蓝 |
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g上述样品与2.0 mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示: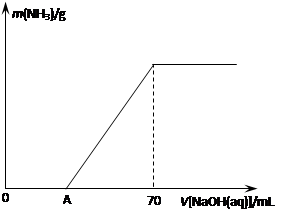
请回答下列问题:
⑴A点前样品与NaOH反应的离子方程式为 ▲ 。
⑵为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的 ▲ 。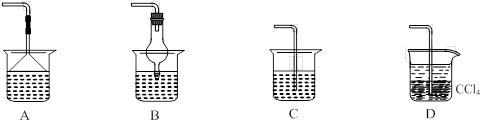
⑶样品中(NH4)2CO3的质量分数是 ▲ %(保留一位小数)。
⑷当V[NaOH(aq)]="50" mL时,生成NH3的质量为 ▲ 。
氨是一种重要的化工产品,其化学式为 ,具有 气味,密度比空气的 (填“大”或“小”), (填“易”或“难”)溶于水,因此,收集氨气应采用_______________法。
发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)N2H4燃烧时用NO2作氧化剂,它们相互反应生成氮气和水蒸气。
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为 。
(2)利用肼、氧气与KOH溶液组成碱性燃料电池,氮元素被氧化后只生成氮气,请写出该电池工作时负极的电极反应 ;电池工作时, 极pH升高。
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的化学方程式 。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式 。
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)该反应产生标准状况下11.2升CO气体,则电子转移 摩尔。
(4)若有1摩尔焦炭与足量的SiO2、氮气反应,电子转移 (填大于、等于或小于)2摩尔,理由是 。
氨是最重要的氮肥原料。在课本里学到的合成氨技术叫哈伯法,近一个世纪,合成氨需要高温高压似乎是天经地义了。然而,最近有两位希腊化学家在《科学》杂志上发表文章说,在常压下把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池(如图),氢气和氮气便可在电极上合成氨,转化率竟然高达78%。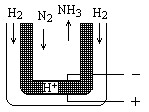
请根据以上材料回答下列问题:
(1)写出哈伯法合成氨的化学方程式: ;其反应条件中,符合平衡移动原理的反应条件是
(2)新法合成氨的电解池中能否用水溶液作电解质? (填“能”、“不能”)
为什么?
(3)电解池中,阳极发生 (填得或失)电子氧化反应,变价元素化合价 (填升高或降低)
(4)新法合成氨中所用的电解质(如图中黑细点所示)能传导H+,试写出电极反应式和总反应式。阳极: ;阴极___________________________
总反应式:__________________________________。