(1)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“>”或“=”或“<”)。
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH—)= mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中c(OH-)= mol/L,由水电离产生的c(H+)= mol/L,此时温度 25℃(填“高于”、“低于”或“等于”)。
现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号) 。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 。
(4)已知t℃,KW=1×10-13,在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
写出下列电解质在水溶液中的电离方程式
(1)Ca(HCO3)2:_____________________________;
(2)H2SO3:_____________________________;
写出下列电解质在水溶液中的水解离子方程式
(3)CH3COONa:_____________________________;
(4)Fe2(SO4)3:_____________________________。
(原创)I.现有以下物质:①铁 ②稀硝酸 ③明矾 ④液氨 ⑤冰醋酸 ⑥蔗糖溶液 ⑦无水乙醇 ⑧熔融态的氢氧化钠⑨硫酸钡晶体 ⑩三氧化硫气体,回答下列问题(用相应物质序号填写):
(1)可以导电的有 。(2)属于强电解质的有 。
II. A、B、C、D四种溶液分别是氢氧化钡溶液、氨水、醋酸溶液、盐酸中的一种。
已知同浓度的四种溶液:①加入大小完全相同的锌粒,仅A、C中放出气体,且开始时A中冒气泡的速度快;②相同条件下,取B、D溶液进行导电性实验,发现导电能力最差的是D。回答下列问题:
(3)D溶液为 ;同浓度的四种溶液中,pH值最大的是 (填化学式) 溶液。
(4)pH值和体积均相同的A和C溶液,分别与足量且大小完全相同的锌粒反应,开始时的反应速率v(A) v(C) (填“>”、“<”或“=”,下同),最终产生气体的物质的量n(A) n(C)。
(5)等体积等浓度的氨水和盐酸混合后,所得溶液呈 (填“酸性”、“碱性”或“中性”),用离子方程式解释其原因 。
(6)0.1mol/L氨水中除水分子以外的粒子有 (填化学式)。
在氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其溶于水后加少量盐酸配制成水溶液,然后按下图所示的操作步骤进行提纯。
已知Cu2+、Fe2+在pH=4~5时不水解,而Fe3+几乎完全水解而沉淀。
(1)加入氧化剂的目的_______________;
(2)下列物质都可以作为氧化剂,其中最适合本实验的是_____;
| A.H2O2 | B.KMnO4 | C.NaClO | D.K2Cr2O7 |
(3)物质Y是_________,加入Y的目的______________,沉淀E是_______________;
(4)欲将CuCl2•2H2O加热制得无水CuCl2,要采用什么方法和措施?_______________________
现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号) 。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 。
(4)已知t℃,KW=1×10-13,在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
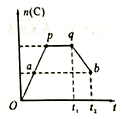
(1)在一定条件,可逆反应:mA+nB pC达到平衡状态。
pC达到平衡状态。
①若A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡向______(填“正”或“逆”)反应方向移动。
②若A、B、C均为气体,且m+n<p,加热后,可使混合气体平均摩尔质量增加,则正反应是______(填“吸热”或“放热”)反应。
③若在反应过程中,C的物质的量n(C)随时间的变化关系如右图所示(从t1时间开始对反应体系升高温度)。则a、b两点的正反应速率:v(a)______v(b)(填“>”、“<”或“=”);
(2)Na2CO3溶液呈碱性,其原因是(用离子方程式表示)___________________;由同浓度的Na2CO3和NaHCO3组成的混合溶液中离子浓度由大到小的顺序为____________________;
(3)某温度下,纯水的c(H+)=3×10-7mol/L,Na2S和NaOH两溶液的pH均为12,则两溶液中由水电离出的c(OH-)的比值为_________________;
(4)下列事实一定能说明HF是弱酸的是__________;
①常温下NaF溶液的pH大于7 ②常温下0.1mol/L的HF溶液pH=2.3
③HF能与Na2CO3溶液反应,产生CO2气体 ④1mol/L的HF水溶液能使紫色石蕊试液变红
0.1mol/L的NaHSO3溶液中,有关粒子浓度由大到小的顺序为:
c (Na+)>c (HSO3-)>c (SO32-)>c (H2SO3)
(1)该溶液中c (H+) c (OH-)(填“>”、“=” 或“<” ),其理由是(结合离子方程式说明): 。
(2)将NaHSO3溶液逐滴加入到含有酚酞的NaOH溶液,可观察到的现象是 ,反应的离子方程式为: 。
I.在一定温度下,有a.盐酸b.硫酸c.醋酸三种酸:
(1)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是__________。
(2)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的______H2(相同状况),则开始时反应速率的大小关系为__________,反应所需时间的长短关系是__________。
II.常温下,有浓度均为1 mol·L-1的下列四种溶液:
①H2SO4溶液 ②NaHCO3溶液 ③NH4Cl溶液 ④NaOH溶液
(1)溶液pH由大到小的顺序是______,其中由水电离的H+浓度最小的是______。(均填序号)
(2)③中各离子浓度由大到小的顺序是______ __,升高温度,NH4Cl溶液的pH (填“升高”、“降低”或“不变”)
(3)向③中通入少量氨气,此时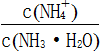 的值______(填“增大”、“减小”或“不变”)。
的值______(填“增大”、“减小”或“不变”)。
(4)将③和④混合后溶液恰好呈中性,则混合前③的体积______④的体积(填“大于”、“小于”或“等于”)。
I.计算(以下均为常温下)(1)pH=2的H2SO4溶液中水电离出的c(H+)=__________
(2)pH=2的NH4Cl溶液中水电离出的c(H+)=__________
(3) pH=2的H2SO4溶液与pH=5 H2SO4以体积比1:9混合,混合后溶液的pH=_________
(4) pH=12的NaOH溶液与pH=4的 H2SO4混合后溶液呈中性,则V(NaOH):V(H2SO4)= _________
II.25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数 |
1.7×10-5 |
K1=4.3×10-7 K2=5.6×10-1 1 |
3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__________________
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为___________
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是__________________________________________。
常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1)上述溶液中,可发生水解的是_______ _(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为_________________________。
(3) 向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”、“减小”或“不变”)。
(4) 若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
(5) 取10 mL溶液③,然后加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________ 。
下列盐溶液中能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样,并说明溶液的酸碱性:
KHCO3 ,溶液呈 性;
K2SO4 ,溶液呈 性;
CuCl2 ,溶液呈 性。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的 pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸___________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________(选填“是”或“否”),混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________________。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是____________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)=________mol·L-1 , c(OH-)-c(HA)=________mol·L-1
(1)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的

①c电极为_____,d电极上的电极反应式为______________________。
②图乙是用惰性电极电解100mL 0.5mol·L-1 CuSO4溶液,a电极上的电极反应式为________________。若a电极产生56mL(标准状况)气体,则所得溶液的pH=_______________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入____________(选填字母序号)
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |
回答下列问题:
(1)某溶液可能呈酸性或碱性,此外还有Na+、SO42-和Cl-,且测得此三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为 。
(2)在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是 。
(3)液氨类似于水的电离,试写出液氨的电离方程式 。
(4)某二元酸(H2A)在水中的电离方程式是:H2A=H++HA- , HA- H++A2-,用离子方程式表示Na2A溶液呈酸碱性的原因:
H++A2-,用离子方程式表示Na2A溶液呈酸碱性的原因: