用相关化学知识进行判断,下列结论错误的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
| B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
| C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D.增大反应物浓度可加快反应速度,因此用浓硫酸与铁反应能增大生成H2的速率 |
为了得到比较纯净的物质,使用的方法恰当的是( )
| A.向Na2CO3饱和溶液中,通入过量的CO2后,加热、蒸发得到NaOH晶体 |
| B.向Fe2(SO4)3溶液加入足量NaOH溶液,经过过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 |
| C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 |
| D.加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 |
下列关于电解质溶液的叙述正确的是( )
| A.室温下,pH=3的氢氟酸加水稀释后,电离常数Ka(HF)和pH均减小 |
| B.室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色 |
C.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中 增大 增大 |
| D.室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)=c(NH4+) |
已知某温度下蒸馏水中的c(H+)=1×10-6mol/L,在此温度下将甲酸和氢氧化钠溶液混合,所得溶液的pH=7,此溶液中( )
| A.c(HCOO-)<c(Na+) | B.c(HCOO-)>c(Na+) |
| C.c(HCOO-)=c(Na+) | D.无法确定c(HCOO-)与c(Na+)的关系 |
分析下表,下列选项中错误的是
| 化学式 |
NH3·H2O |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×l0—5 |
1.8×l0—5 |
4.9×l0—10 |
K1= 4.3×l0—7, K2= 5.6×l0—11 |
A.0.1mol·L-1CH3COONa 溶液显碱性,0.1mol·L-1CH3COONH4溶液显中性
B.等物质的量浓度的NaHCO3和NaCN溶液,前者溶液中水的电离程度大
C.NaCN + H2O + CO2 (少量) =" HCN" + NaHCO3
D.上述3种等体积等pH的酸溶液,分别加水稀释后pH仍相等,则醋酸中加入水的体积最少
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
下列关于盐类水解反应的应用说法正确的是( )
| A.可以用Cu除去CuCl2溶液中的杂质离子Fe3+ |
| B.将FeCl3溶液蒸干并灼烧得到Fe2O3固体 |
| C.Al(NO3)3溶液与K2S溶液混合后无明显现象 |
| D.Mg粉投入到饱和NH4Cl溶液中无明显现象 |
温度和浓度均相同的下列溶液:①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4Cl、⑤NaClO⑥CH3COONa,它们的pH值由小到大的排列顺序是( )
| A.③①②④⑤⑥ | B.⑤⑥②④①③ | C.③①④②⑥⑤ | D.③①⑥④②⑤ |
已知25℃时,乙酸和三氯乙酸的电离常数分别是:Ka(CH3COOH)═1.80×10-5,Ka(CCl3COOH)═0.60, 在物质的量浓度均为0.1mol•L-1的CH3COONa和CCl3COONa混合溶液中,下列关系正确的是
| A.c(Na+)═c(CCl3COO-)+c(CH3COO-) |
| B.c(CCl3COO-)-c(CH3COO-)═c(CH3COOH)-c(CCl3COOH) |
| C.c(OH-)>c(CCl3COO-)>c(CH3COO-) |
| D.c(CH3COOH)>c(CCl3COOH)>c(OH-) |
现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡。六种元素的原子半径与原子序数的关系如图所示。下列推断正确的是
| A.原子半径和离子半径均满足:Y<Z |
| B.氢化物的沸点排序 :Y>T>R |
| C.最高价氧化物对应的水化物的酸性 :T<R |
| D.单质氧化性:Y>R>T |
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确
的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度一定降低
②pH=2的盐酸和pH=1的盐酸,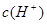 之比为2:1
之比为2:1
③pH相等的四种溶液:a.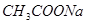 ;b.
;b.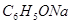 ;c.
;c.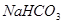 ;d.
;d.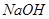 .其溶液物质的量浓度由小到大顺序为d、b、c、a
.其溶液物质的量浓度由小到大顺序为d、b、c、a
④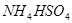 溶液中滴加NaOH溶液至溶液pH=7,则
溶液中滴加NaOH溶液至溶液pH=7,则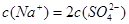
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为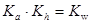
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
| A.③⑤⑥ | B.③④⑥ | C.④⑤⑥ | D.①②④ |
在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO4 ②H2SO3 ③NaHSO3 ④Na2S,所含带电微粒的数目由多到少的顺序是 ( )
| A.①=④>③=② | B.①=④>③>② | C.①>④>③>② | D.④>①>③>② |
对于0.1mol•L-1 Na2CO3溶液,正确的是
| A.升高温度,溶液的pH降低 |
| B.c(Na+)=2c(CO32―)+c(HCO3―)+ c(H2CO3) |
| C.c(Na+)+c(H+)=2c(CO32―)+ 2c(HCO3―)+ c(OH―) |
| D.加入少量NaOH固体,c(CO32―)与c(Na+)均增大 |
为了除去ZnCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,使溶液的pH升高,过滤后再向溶液中加入适量盐酸,这种试剂不应该是
| A.ZnO | B.K2CO3 | C.Zn(OH)2 | D.ZnCO3 |