| A.所得混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.混合后溶液pH=7 |
| C.所得混合液中存在c(CH3COOH)+ c(CH3COO-)=0.05mol/L |
| D.混合后溶液中存在c(CH3COOH)+c(CH3COO-)=c(Na+)+ c(H+) |
以下对298K时,pH值为9的KOH溶液和pH值为9的Na2CO3溶液中由水电离出的[OH-]
的比较,正确的是 ( )
| A.两者相等 | B.前者是后者的105倍 |
| C.后者是前者的104倍 | D.无法比较 |
相同温度下等物质的量浓度的下列溶液中,pH最小的是( )
| A.NH4Cl | B.NH4HCO3 | C.NH4HSO4 | D.(NH4)2SO4 |
常温下,已知0.1 mol·L-1 HA(一元酸)溶液中c(H+):c(OH-)=1010,0.5 mol·L-1 B(OH)2(二元碱)溶液中pH=14。将浓度均为0.1 mol·L-1的两种溶液等体积混合后,混合溶液中下列离子浓度的大小关系正确的是 ( )
| A.c(H+)<c(OH-)<c(A-)<c(B2+) | |
B.c(OH-)<c(H+)<c(B2+)<c(A-) |
C.c(H+)+2c(B2+)=c(OH-)+c(A-) |
| D.2c(A-)=c(B2+)>c(H+)=c(OH-) |
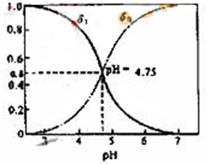
分配系数是指弱电解质溶液中,溶质某种型体浓度与溶质型体总浓度的比值。分配曲线是指弱电解质溶液平衡状态时,每种型体浓度的分配系数与PH之间的关系曲线。对于CH3COOH总浓度c,它只有两种型体,平衡浓度分别为c(CH3COOH)、c(CH3COO-),则c= c(CH3COOH)+c(CH3COO-),设CH3COOH所占分配系数为δ1,CH3COO-所占分配系数为δ0,它们与PH的关系如图所示。下列有关说法正确的是( )
| A.由曲线可知在PH为1~7时,一定有δ1+δ0=1 |
B.c mol/L 的CH3COOH溶液与c mol/LCH3COONa溶液等体积混合溶液显碱性 的CH3COOH溶液与c mol/LCH3COONa溶液等体积混合溶液显碱性 |
C.向CH3COOH溶 液中不断滴加氢氧化钠溶液,若c(CH3COO-) >c(Na+) >c(H+)> c(OH-)则δ1一定大于δ0 液中不断滴加氢氧化钠溶液,若c(CH3COO-) >c(Na+) >c(H+)> c(OH-)则δ1一定大于δ0 |
D.在 cmol/L的H2C2O4(草酸)溶液中,一定满足c(H2C2O4)+ c(C2O42-)=c cmol/L的H2C2O4(草酸)溶液中,一定满足c(H2C2O4)+ c(C2O42-)=c |
一种常用的泡沫灭火器构造如右图。内筒a是玻璃瓶,外筒b是钢瓶,平时泡沫灭火器内筒外筒盛 有液态试剂,当遇火警时,将灭火器取下倒置,内筒外筒液体试剂立即混和产生大量CO2泡沫灭火,从液态试剂在灭火器中长久放置和快速灭火两个角度分析,盛放药品正确的是
有液态试剂,当遇火警时,将灭火器取下倒置,内筒外筒液体试剂立即混和产生大量CO2泡沫灭火,从液态试剂在灭火器中长久放置和快速灭火两个角度分析,盛放药品正确的是
| A.a中盛饱和Na2CO3溶液,b中盛Al2(SO4)3溶液 |
B.a中盛饱和NaHCO3溶液, b中盛Al2(SO4)3溶液 b中盛Al2(SO4)3溶液 |
| C.a中盛Al2(SO4)3溶液,b中盛饱和Na2CO3溶液 |
| D.a中盛Al2(SO4)3溶液,b中盛饱和NaHCO3溶液 |
通过对下图的观察,有以下几种叙述,其中不正确的是( )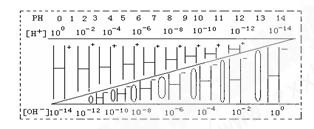

| A.该温度下,不论何种水溶液中c(H+)·c(OH-)乘积相等,即水的离子积是一个常数 |
| B.若醋酸钠溶液中c(Na+)=c(CH3COO-),则溶液中的c(H+)=c(OH-) |
| C.如果定义pOH=-lg[c(OH-)]时,则该温度下某水溶液中的pOH和pH之和等于14 |
| D.某水溶液由于条件的改变,如果氢离子浓度变小,则氢氧根离子浓度一定变大 |
现在有两种正盐的稀溶液,分别是amol·L-1NaX溶液和bmol·L-1NaY溶液,下列说法不正确的是( )
| A.若a>b,测得c(X-)= c(Y-),可以推出溶液中的c(HX)>c(HY) |
| B.若a>b,测得c(X-)= c(Y-),可以推出溶液中的c(HX)<c(HY) |
| C.若a=b,且pH(NaX)> pH(NaY),则相同浓度时,酸性:HX<HY |
| D.若a=b,并测得c(X-)= c(Y-)+ c(HY),则HX是强酸,HY是弱酸 |
由一价离子组 成的四种盐:AC、BD、AD、BC的1 mol·L-1的溶液,在室温下前两种溶液的pH=7,第三种溶液pH>7,最后一种溶液pH<7,则 ( )
成的四种盐:AC、BD、AD、BC的1 mol·L-1的溶液,在室温下前两种溶液的pH=7,第三种溶液pH>7,最后一种溶液pH<7,则 ( )
| |
A |
B |
C |
D |
| 碱性 |
AOH>BOH |
AOH<BOH |
AOH>BOH |
AOH<BOH |
| 酸性 |
HC>HD |
HC>HD |
HC<HD |
HC<HD |