分物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)_________ ___________________________。
(3) 某温度时,0.01mol/L的NaOH溶液pH=11,则该温度__________25℃(填“>”、“<”或“=”)。在此温度下,某溶液中由水电离出来的H+浓度为1×10-10 mol/L,则该溶液的pH为_________。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈__________(填“酸性”、“碱性”或“中性”),溶液中c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
(5)若物质的量浓度相同的CH3COOH和NaOH溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈___(填“酸性”、“碱性”或“中性”),醋酸体积____氢氧化钠溶液体积(填“>”、“<”或“=”)。
(6)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)  Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
分已知溶液中只存在OH-、H+、Na+、CH3COO-四种离子,试回答下列问题:
(1)若溶液中只溶解了一种溶质,则该溶质是___________,溶液中c(H+)_____c(OH-)(填“>”、“=”或“<”)。
(2)若溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则该溶液中的溶质为_____________,若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则该溶液中溶质为_________________。
(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,且恰好呈中性,则混合前c(NaOH)__________c(CH3COOH),混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)__________c(H+)(填“>”,“=”或“<”)。
已知某温度下0.1mol·L-1的NaHB(强电解质)溶液中c(H+)>c(OH-),则下列有关说法或关系式一定正确的是( )
①HB-的水解程度小于HB-的电离程度; ②c(Na+)=0.1mol·L-1 > c(B2-);
③溶液的pH=1; ④ c(Na+)= c(HB-)+2 c(B2-)+ c(OH-)、
| A.①② | B.②③ | C.②④ | D.①②③ |
下列说法不正确的是( )
A.常温下,向醋酸钠溶液中滴加盐酸至溶液呈中性一定有:c(CH3COOH)= c(Cl-)
B.某酸式盐NaHA溶液中一定有:c (OH-)+c(A2-)= c(H+)+c(H2A)
C.NaHSO4溶液中滴加Ba(OH)2至溶液恰好呈中性c(Na+)>c(SO42-)>c(OH-)=c(H+)
D.0.5 mol/L 的Na2S溶液中:1/2c(Na+)=c(H2S)+c(HS-)+c(S2-)="0.5" mol/L
下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。

已知:298K时,Ksp[Cu(OH)2]=2.2×10-20, Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2] =1.9×10-13。
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)过量的还原剂应是 。
(3)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为
。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(4)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: ﹥ ﹥ 。(填金属阳离子)
(5)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L(用含Z的代数式表示);阳极产生的最后一种气体的反应式为 。
室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如下图所示。下列说法正确的是( )
A.V(NaOH)=10.00 mL 时, |
| B.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 |
| C.pH=7时,两种酸所用NaOH溶液的体积相等 |
| D.V(NaOH)=20 .00 mL 时,c(Cl-)<c(CH3COO-) |
下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
A.0.1 mol·L-1 Na2CO3溶液中:c(Na+)=c(HCO )+c(H2CO3)+2c(CO )+c(H2CO3)+2c(CO ) ) |
| B.pH=12的Ba(OH)2溶液和pH=12的NaHCO3溶液中,水电离的c(H+)相等 |
| C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸溶液等体积混合所得碱性溶液中: c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D.常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后c(OH-)< c(H+) |
下列有关物质的量浓度关系正确的是
A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液呈酸性:
c(CH3COO-)<c(CH3COOH)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
D.pH=2的HA溶液与pH=12的MOH溶液任意比混合后溶液中离子浓度关系:
c(H+)+c(M+)=c(OH-)+c(A-)
下列溶液中各微粒的浓度关系正确的是
| A.物质的量浓度相等的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液, c (NH4+)的大小顺序为:①>②>③ |
| B.pH相等的NaF与CH3COOK溶液:c(Na+)-c(F —)>c(K+)-c(CH3COO—) |
| C.0.2 mo1·L —1的Na2CO3溶液:c(OH—)=c(HCO3—)+c(H+)+2c(H2CO3) |
D.0.2 mo1·L —1 HCl与0.1 mo1·L —1 NaAlO2溶N液等体积混合: c(Cl—)> c(Na+)>c(Al3+)>c(H+)>c(OH—) c(Cl—)> c(Na+)>c(Al3+)>c(H+)>c(OH—) |
有①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
| A.三种溶液pH的大小顺序是③>②>① |
| B.若将三种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25mL 0.1mol/L盐酸后,pH最大的是① |
| D.若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
I.25℃时,三种酸的电离常数为:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数 |
1.8×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
3.0×10-8 |
请回答下列问题:
(1)物质的量浓度为0.1mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是: ;(填编号)
(2)常温下将0.1mol/L的CH3COOH溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是: ;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
Ⅱ.在一个容积固定不变的密闭容器中进行反应2X(g)+Y(g)  2Z(g),已知将2molX,1molY充入该容器中反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答问题:
2Z(g),已知将2molX,1molY充入该容器中反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答问题:
若把2molX,1molY充入该容器时处于状态I,达到平衡时处于状态Ⅱ,
则该反应的焓变△H 0(填“〉” “〈”或“=”,下同〉,熵变△S 0,该反应在 (填“高温”、“低温”)条件下能自发进行。
Ⅲ. 在容积可变的密闭容器中发生可逆反应 m A(g) + n B(g)  pC(g) ,在一定温度和不同压强下达到平衡,分别得到A的物质的量浓度如表:
pC(g) ,在一定温度和不同压强下达到平衡,分别得到A的物质的量浓度如表:
| 压强p(Pa) |
2x105 |
5x105 |
1x106 |
| c(A)mol/L |
0.08 |
0.20 |
0.44 |
当压强从2x105Pa增加到5x105Pa时,平衡 (填“向左”、“向右”或“不”)移动。维持压强2x105Pa,反应达到平衡时,体系共amol气体,再向体系充入bmolB气体,重新达到平衡时,体系中气体总的物质的量为 。当压强从5x105Pa增加到1x106 Pa时,平衡 (填“向左”、“向右”或“不”)移动,原因是 。
下列溶液中微粒的物质的量浓度关系正确的是( )
A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)=c(NH )=c(Cl-) )=c(Cl-) |
| B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:c(HCOO-)+ c(H+)>c(Na+)+c(OH-) |
| D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+) |
浅绿色的硫酸亚铁铵晶体【又名莫尔盐(NH4)2SO4•FeSO4•6H2O】比绿矾(FeSO4•7H2O )更稳定,常用于定量分析。莫尔盐的一种实验室制法如下: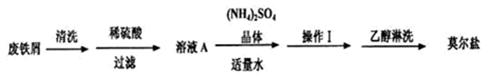
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是_________________;证明溶液A不含Fe3+离子的最佳试剂是_______________(填序号字母)。
a.酚酞溶液 b.KSCN溶液 c.烧碱溶液 d.KMnO4溶液
操作I的步骤是:加热蒸发、___________、过滤。
(2)浓度均为0.1mol·L-1莫尔盐溶液和(NH4)2SO4溶液,c(NH4+)前者大于后者,原因是______。
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平_______(填“左”“右”)盘。
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接__________;__________接__________。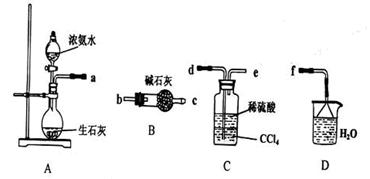
将装置C中两种液体分离开的操作名称是_________。装置D的作用是_______________。
下列有关离子的各种说法中,正确的是
| A.金属钠溶于足量水中的离子方程式:Na+2H2O=Na++H2↑+2OH- |
| B.加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、Cl-可以大量共存 |
| C.等物质的量浓度、等体积的氨水与盐酸混和,溶液中离子浓度关系为 c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中 c(K+)=c(H2X)+c(HX-)+c(X2-) |