下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
下列说法正确的是( )
| A.pH=12的NaOH溶液中,c(H+)=10-12 mol·L-1,稀释为原体积的10倍后c(H+)=mol·L-1=10-13mol·L-1 |
| B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液因生成的CH3COONa水解,pH>7 |
| C.pH=3的HA酸溶液中c(H+)=10-3 mol·L-1,稀释为原体积的10倍后pH≤4 |
| D.pH=11和pH=13的NaOH溶液等体积混合后,溶液中的c(H+)=mol·L-1 |
今有室温下四种溶液,有关叙述不正确的是( )
| |
① |
② |
③ |
④ |
| pH |
11 |
11 |
3 |
3 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
| A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小 |
| B.分别加水稀释10倍,四种溶液的pH:①>②>④>③ |
| C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va∶Vb=11 ∶9 |
25℃时,pH=13的氨水中由水电离出的c(H+)=a,pH=1的盐酸中由水电离出的c(H+)=b,0.2 mol·L-1盐酸与0.1 mol·L-1氢氧化钠溶液等体积混合后,由水电离出的c(H+)=c,则a、b、c的关系正确的是( )
| A.a>b=c | B.a=b=c |
| C.c>a=b | D.a>c>b |
氨气的水溶液称为氨水,它的主要存在微粒是NH3·H2O。已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol/L b.CH3COOH+NaHCO3=CH3COONa +CO2↑+H2O
+CO2↑+H2O
则CH3COONH4溶液呈 性(填“酸”、“碱”或“中”),NH4HCO3溶液呈 性(填“酸”、“碱”或“中”),NH4HCO3溶液中浓度最大的离子是 (填离子的化学式)。
常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 CH3COOH溶液,滴定曲线如下图。下列说法正确的是( )
| A.点①所示溶液中:[CH3COO-]+[OH-]=[CH3COOH]+[H+] |
| B.点②所示溶液中:[Na+]=[CH3COOH]+[CH3COO-] |
| C.点③所示溶液中:[Na+]>[OH-]>[CH3COO-]>[H+] |
| D.滴定过程中可能出现: |
[CH3COOH]>[CH3COO-]>[H+]>[Na+]>[OH-]
下列叙述中,不正确的是 ( )
| A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl) |
| B.10 mL 0.10 mol·L―1 CH3COOH溶液加入等物质的量的NaOH后,溶液中有 c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和(a+1),则有c1=10c2 |
| D.NaHCO3溶液中:c(H+) + c(H2CO3)=c(CO32-) + c(OH-) |
下列说法正确的是
| A.酸性溶液中水的电离程度一定比纯水的电离程度小 |
| B.室温下:pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| C.HA的酸性比HB的强,则Na A溶液的pH一定比NaB溶液的小 |
D.0.1mol/L Na2CO3溶液和0.1mol/L NaHSO4溶液等体积混合,溶液中c(Na+)> c(SO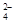 ) >c(HCO ) >c(HCO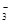 )> c(OH-)> c(H+) )> c(OH-)> c(H+) |
下列溶液中离子浓度的关系一定正确的是( )
| A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B.pH=3的一元酸HX溶液和pH =11的一元碱MOH溶液等体积混合: c(M+)=c(X)>c(H+)=c(OH-) |
| C.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液: c(CH3COO-)>c(CO32-)>c(C6H5O-) |
| D.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中: |
c(K+)=c(H2X)+c(HX-)+c(X2-)
(18分)以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—99.3%)的工艺流程为(可能用到的原子量Cl 35.5 Ca 40 O 16)
(1)CaCO3与盐酸反应的离子方程式 。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:
① ,②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括 、 、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 .(只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为 。
关于浓度均为0.1 mol/L的三种溶液:①CH3COOH、②NaOH、③CH3COONa溶液,下列说法不正确的是
| A.c(CH3COO-):③>① |
| B.水电离出的c(OH-):②>① |
C.①和②等体积混合后的溶液: c(OH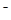 )=c(H+)+ c(CH3COOH) )=c(H+)+ c(CH3COOH) |
D.①和③等体积混合后的溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH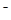 ) ) |
化合物SOCl2是一种液态 化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消
化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消 失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出.
失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出.
(1)根据上述实验,写出SOCL2和水反应的化学方程式  __.
__.
(2)AlCl3溶液蒸干灼 烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O 混合共热,可得到无水AlCl3,其原因是 __________________________ __________________.
烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O 混合共热,可得到无水AlCl3,其原因是 __________________________ __________________.
下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
| A.0.1 mol/L的(NH4)2SO4溶液中:c(SO42—) > c(NH4+) > c(H+) > c(OH—) |
| B.0.2mol/L的Na2CO3溶液中:c(OH—)= c(HCO3—) +c(H+)+2 c(H2CO3) |
| C.0.1mol/L的NH4Cl溶液与0.05mol/L的NaOH溶液等体积混合,其混合溶液中: c(Cl—) >c(NH4+) > c(Na+)> c(H+)> c(OH—) |
| D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液中: |
c[(NH4)2SO4] < c[(NH4)2CO3] < c(NH4Cl)
下列关于电解质溶液的叙述正确的是 ( )
| A.常温下,NH4Cl与某物质的混合溶液pH<7,则其组成可能是NH4Cl与HCl或NH4Cl与NH3?H2O |
| B.将pH=5的氢氟酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.常温下,同浓度的Na2S与NaHS溶液中所含的粒子种类相同 |
| D.将一元酸HA溶液与一元碱BOH溶液等体积混合,若所得溶液呈酸性,则混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-) |