20℃时,两种一元弱酸的钠盐NaX和NaY,已知,往NaX溶液中 通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3,下列说法正确的是( )
通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3,下列说法正确的是( )
A.酸性HY>HX |
B.结合H+的能力Y->CO >X->HCO >X->HCO |
| C.溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | D.HX和HY酸性相同但比H2CO3弱 |
表示0.1mol/LNaHCO3溶液中有关微粒浓度大小的关系式,正确的是( )
| A.(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) |
| B.(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| C.c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-) |
| D.c(H+)>c(H2CO3)>c(OH-)>c(HCO3-)>c(CO32-) |
下列有关溶液中粒子浓度的关系式中,正确的是
A.pH相同的①CH3COONa、②NaHCO3、③  三份溶液中的c(Na+):③>②>①
三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中: c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.右图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.右图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
关于NaHCO3溶液的表述正确的是( )
| A.c( Na+) = c( HCO3-) + c( CO32-) + c( H2CO3 ) |
| B.c( Na+ ) + c( H+) = c( HCO3-) + c( CO32-) +c( OH- ) |
| C.HCO3-的电离程度大于HCO3-的水解程度 |
D.存在的电离平衡有: HCO3—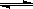 H++CO3 H++CO3 2—,H2O 2—,H2O 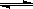 H++OH— H++OH— |
下列比较中,正确的是 ( )
| A.相同条件下,HF比HCN易电离,则NaF溶液的 pH 一定比 NaCN 溶液小 |
| B.0.2 mol•L-l NH4Cl 和 0.l mol•L-l NaOH 溶液等体积混合后: c(NH4+) > c (Cl-) > c (Na+) > c (OH-) >c (H+) |
| C.1 L 0.l mol·L-1(NH4)2SO4· FeSO4·6H2O的溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
| D.相同温度下,同浓度的下列溶液中,①NH4Al(SO4)2②NH4Cl③NH3·H2O ④CH3COONH4 |
c(NH4+) 由大到小的顺序是:①> ②> ④> ③
25℃时,向10mL 0.01mol/L KOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的是( )
| A. pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH―) |
| B. pH<7时,c(K+)>c(C6H5O-)> c(H+)>c(OH―) |
| C. V [C6H5OH(aq)]=10mL时,c(K+)=c(C6H5O-)>c(OH―)=c(H+) |
| D.V [C6H5OH(aq)]=20mL时,c(C6H5O-)+c(C6H5OH)=2c(K+) |
25 ℃时,几种弱酸的电离常数如下:
| 弱酸化学式 |
CH3COOH |
HCN |
H2S |
| 电离常数(25 ℃) |
1.8 ×10-5 |
4.9 ×10-10 |
K1="1.3" ×10-7 K2="7.1" ×10-15 |
下列说法正确的是( )
A. 等物质的量浓度的各溶液pH关系为: pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B. a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CN-),则a一定大于b
C. NaHS和Na2S混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c( S2-)
S2-)
D. 某浓度HCN的水溶液pH=d,则其中c(OH-)=10-d mol/L
已知二元酸H2A在水中存在以下电离:H2A===H++HA-, HA-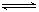 H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
(1)NaHA溶液呈________性,理由是 。
(2)某温度下,向10 mL 0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母)。
| A.c(Na+)+c(K+)=c(HA-)+c(A2-) | B.水的离子积KW=c 2(OH-) 2(OH-) |
| C.V=10 | D.c(K+)<c(Na+) |
(3) 已知难溶物CaA在水中存在溶解平衡;CaA(s)
已知难溶物CaA在水中存在溶解平衡;CaA(s) 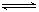 Ca2++A2-;ΔH>0。
Ca2++A2-;ΔH>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
②向浊液中通入HCl气体,c(Ca2+)________,原因是 。
(4)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3。甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为_______,通过计算确定上述方案______(填“可行”或“不可行”)。
常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)①混合溶液中由水电离出的c(H+)________HCl溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________mol/L;c(H+)-c(MOH)=________mol/L。
(2)常温下若将0.2 mol/L MOH溶液与0.1 mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度______MCl的水解程度。(填“>”、“<”或“=”)
25℃时,向10ml0.01mol/LKOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的
| A.pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-) |
| B.pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-) |
| C.V[C6H5OH(aq)]=10ml时,c(K+)=c(C6H5O-)>c(OH-)=c(H+) |
| D.V[C6H5OH(aq)]=20ml时,c(C6H5O-)+c(C6H5OH)=2c(K+) |
常温下,向 20 mL 0.1 mol·L-1CH3COOH溶液中滴加0.1 mol·L-1NaOH溶液。下列说法正确的是
| A.当溶液的pH=7时:c(Na+) = c(CH3COO-) + c(CH3COOH) |
| B.当加入10 mL 0.1 mol·L-1NaOH溶液时:c(CH3COO-) +2 c(OH-) = c(CH3COOH) + 2c(H+) |
| C.当加入20 mL 0.1 mol·L-1NaOH溶液时:c(Na+) >c(OH-) >c(CH3COO-) > c(H+) |
| D.滴定过程中可能有:c(CH3COOH) >c(H+) >c(CH3COO-) >c(Na+) >c(OH-) |
下列说法正确的是
A.常温下0.4 mol/L HB溶液和0. 2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为: c(B—)>c(H+)>c(Na+)>c(OH—)
B.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等
C.常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3·H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
D.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
下列有关电解质溶液中微粒的物质的量浓度关系正确的是 ( )
| A.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)> c(HCO3-)> c(OH-)>c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液pH=7, c(Na+)=0.1 mol·L-1:c(CH3COOH) >c(Na+) >c(CH3COO-)>c(H+)=c(OH-) |
常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是 ( )
| A.pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-) |
| B.pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| D.pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
化合物SOCl2是一种液态化合物,沸点为77℃。在盛10ml水的锥形瓶中小心滴加8-10滴SOCl2可观察到剧烈反应,液面上形成白雾,并有刺激性气味的气体放出,该气体可使湿润的品红试纸褪色。在反应后的溶液中滴加AgNO3溶液,可生成一种不溶于稀HNO3的白色沉淀。
(1)试据上述实验事实,写出SOCl2与水反应的化学方程式 。
(2)将ZnCl2溶液蒸发至干,得不到无水ZnCl2,工业上常用ZnCl2•2H2O与SOCl2共热制取ZnCl2。试结合离子方程式解释原因: 。
(3)科学家经常利用 水解原理制备纳米材料,请写出用TiCl4制备TiO2·xH2O的化学方程式: 。
水解原理制备纳米材料,请写出用TiCl4制备TiO2·xH2O的化学方程式: 。