常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________________。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)=________mol·L-1 c(OH-)-c(HA)=________mol·L-1
已知水在25℃和95℃时,其电离平衡曲线如下图所示:
(1)25℃时水的电离平衡曲线应为 (选填“A”或“B”)
(2)25℃时,将PH=9的NaOH溶液与PH=4的盐酸溶液混合,若所得混合溶液的PH=7,则NaOH溶液与盐酸溶液的体积比为 。
(3)95℃时,若100体积PH=a的某强酸溶液与1体积ph=b的某强碱溶液混合后溶液呈中 性,则混合前,a与b之间应满足的关系是
(10分)A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度,且B2溶液中只有阳离子发生水解反应(已知:HNO2是弱酸)。
(1)写出化学式A1__________,A2_____ _____,B1__________,B2__________;
_____,B1__________,B2__________;
(2)相同温度下,当A1、B1的物质的量浓 度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为_______________________ _;
度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为_______________________ _;
(3)写出0.1 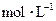 的
的 溶液中离子浓度大小排序 ________________;
溶液中离子浓度大小排序 ________________;
Ⅰ.在一个容积固定为2L的密闭容器中,发生反应:aA (g) + bB(g)  pC(g) ,△H=?,反应情况记录如下表:
pC(g) ,△H=?,反应情况记录如下表:
| 时间/(min) |
n(A)/( mol) |
n(B)/( mol) |
n(C)/( mol) |
| 0 |
1 |
3 |
0 |
| 第2 min |
0.8 |
2.6 |
0.4 |
| 第4 min |
0.4 |
1.8 |
1.2 |
| 第6 min |
0.4 |
1.8 |
1.2 |
| 第8 min |
0.1 |
2.0 |
1.8 |
| 第9 min |
0.05 |
1.9 |
0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率v(A)= mol•L-1• min-1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8 min时分别改变了某一个反应条件,则改变的条件分别可能是:
①第2min 或 ;
②第6min ;③第8 min 。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92kJ则该反应的△H= 。
(4)反应在第4 min建立平衡,此温度下该反应的化学平衡常数K= 。
(5) 判断第9 min时是否达平衡,说明理由 。
Ⅱ.已知:常温下,A酸的溶液pH=a, B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为 。
A.大于7 B.等于7 C.小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mol•L-1,B溶液中水电离出的氢离子浓度为 mol•L-1。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为: 。
常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)①混合溶液中由水电离出的c(H+)________HCl溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________mol/L;c(H+)-c(MOH)=________mol/L。
(2)常温下若将0.2 mol/L MOH溶液与0.1 mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度______MCl的水解程度。(填“>”、“<”或“=”)
I.下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t 1 |
t 2 |
| 水的离子积 KW |
1×10-14 |
1×10-13 |
1×10-12 |
试回答以下问题:
(1)25℃下,某 Na2SO4溶液中 c(SO42-)=5×10-4 mol∙L-1,取该溶液 1mL 加水稀释至10mL,则稀释后溶液中 c(Na+):c(OH-)=____________。
(2)在 t 2℃下,将 a mol∙L-1CH3COOH 溶液与 b mol∙L-1NaOH 溶液等体积混合反应后,溶液恰好呈中性,则该温度下 CH3COOH 的电离常数 Ka=____________(用 a、b 表示)。
II.已知:25℃下,下列反应:①Ag+(aq)+2NH3(aq)  Ag(NH3)2+(aq) △H =" a" kJ∙mol-1 K = c
Ag(NH3)2+(aq) △H =" a" kJ∙mol-1 K = c
②2Ag+(aq)+2OH-(aq)  Ag2O(s)+H2O(l) △H =" b" kJ∙mol-1 K = d
Ag2O(s)+H2O(l) △H =" b" kJ∙mol-1 K = d
(3)写出 Ag2O溶于氨水(用 NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:_____________;
计算 25℃下,该反应的平衡常数(用 c、d 表示)K =____________________。
III.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
| 离子 |
Mg2+ |
Cr3+ |
Cl- |
| 浓度(mol/L) |
0.5 |
0.01 |
a |
已知 25℃时,Ksp[Cr(OH)3]=10-32;Ksp[Mg (OH)2]=5×10-11;操作过程中溶液体积的变化忽略不计。
(4)表格中的 a____________1.03(填“<”、“>”或“=”)。
(5)除去杂质Cr3+离子,可加入MgO调节溶液 pH,理论上应调节 pH 的范围是_______________。
(6)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2∙6H2O)的操作是___________________。
取两支试管,分别加入4mL0.01mol/L的KMnO4溶液,然后向试管①中加入0.1mol/LH2C2O4溶液2mL,记录溶液褪色所需的时间;向试管②中加入0.2mol/L H2C2O4溶液2mL,记录溶液褪色时间,(1)实验表明 褪色更快些。
(2)写出反应的化学方程式 。
(3)在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3- ⑥C2O42-、Br-、K+、Cl-
某研究小组为测定某软锰矿中MnO2的质量分数,查阅资料获得如下信息:KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化,反应过程表示为:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O
小组成员采用滴定的方法测定软锰矿中MnO2的质量分数,设计实验如下:准确称取2.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到100mL容量瓶中并定容;从中分别取出20.00mL待测液置于锥形瓶中,再用0.0200mol·L-1KMnO4标准溶液进行滴定,记录最终读数。数据如下:
| 测定次序 |
第一次 |
第二次 |
第三次 |
第四次 |
| 初始读数(mL) |
0.40 |
0.10 |
0.90 |
0.00 |
| 最终读数(mL) |
25.05 |
20.10 |
21.00 |
19.90 |
试回答下列问题:
(1)0.0200mol·L-1KMnO4标准溶液应置于 (选填“酸式”或“碱式”)滴定管中;滴定终点如何判断 。
(2)你能否帮助该研究小组求得软锰矿中MnO2的质量分数 (选填“能”或“否”)。若回答“能”,请给出计算结果 (保留小数点后两位);若回答“否”,试说明原因 。
(3)若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是 。
A.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
B.滴定前尖嘴部分有一气泡,滴定终点时消失
C.定容时,俯视刻度线
D.滴定前仰视读数,滴定后俯视读数
E.锥形瓶水洗之后未用待测液润洗
(1)常温下将0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①0.2mol/LHCl溶液中由水电离出的c(H+)__________0.2mol/LMOH溶液中由水电离出的c(H+); (填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_________mol/L。
(2)常温下若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的pH>7,则说明在相同条件下MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,则混合溶液的pH_______。(填“>7”、“<7”、或“无法确定”)
(4)用0.1032mol/LHCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示:
| 实验序号 |
0.1032mol/LHCl溶液体积/mL |
待测NaOH溶液体积/mL |
| 1 |
27.83 |
25.00 |
| 2 |
25.53 |
25.00 |
| 3 |
27.85 |
25.00 |
①待测NaOH溶液的物质的量浓度为_________mol/L。(保留四位有效数字)。
②下列情况可能引起测定结果偏高的是__________。
A.锥形瓶未用待测液润洗
B.酸式滴定管未用标准盐酸溶液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
| 化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
| 颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
| Ksp |
1.8×10-10 |
5.0×10-13 |
8.3×10-17 |
2.0×10-48 |
1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的_________。
A.KI B.K2CrO4 C.KBr D.K2S
按要求填写下列相关内容:
(1)在常温下,将体积为VaL、pH为a的稀硫酸和体积为VbL、pH为b的烧碱溶液混合,若所得混合液为中性。如果a+b=15,则Va:Vb=___________。某温度时,水的离子积常数Kw=1×10-13.在此温度下,将pH=a的硫酸溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,如果a+b=12,则Va:Vb=___________。
(2)中和相同体积,相同pH的Ba(OH)2、NH3·H2O、NaOH三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3,则三种关系为______________(用“V1、V2、V3”和“>、<、=”表示)。
(3)今有A.盐酸 B.醋酸 C.硫酸三种酸。
①在同体积、同pH的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是___________。(填酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是__________,反应所用时间长短关系是_____________。
(1)今有①CH3COOH ②HCl ③H2SO4三种溶液,当它们温度相同、pH相同时,其物质的量浓度由大到小排列的顺序是 (用序号表示)。
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液中c(OH-)为__________mol/L。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,请写出最先生成沉淀的离子方程式为 。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
(4)下列说法不正确的是 (填序号)。
| A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| C.除去氯化钠溶液中的Mg2+,用NaOH溶液沉淀Mg2+比用Na2CO3溶液效果好,说明相同温度时Mg(OH)2的溶解度比MgCO3大 |
| D.沉淀反应中常加适当过量的沉淀剂,其目的是使相关离子沉淀完全 |
氨气在工农业生产中有重要应用。
Ⅰ. (1)如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。

①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为_____________________。
②FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O=Fe(OH)2↓+2NH和________________________。
(2)已知氨气极易溶于水,而难溶于有机溶剂CCl4。下列装置中不适宜做氨气尾气吸收的是 。

Ⅱ.现代传感信息技术在化学实验中有广泛的应用。

某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
(1)关闭a,将吸有2mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。图2中 点时喷泉最剧烈。
(2)从三颈瓶中量取25.00mL氨水至锥形瓶中,加入 做指示剂;用0.0500 mol•L-1HCl滴定。终点时溶液颜色由 色变为 色,用pH计采集数据、电脑绘制滴定曲线如下图。

(3)据图,计算氨水的浓度为 mol•L-1;比较当VHCI=17.50ml时溶液中离子浓度大小关系 。
(4)关于该滴定实验的说法中,正确的是 。
| A.锥形瓶中有少量蒸馏水导致测定结果偏低 |
| B.酸式滴定管在滴定前有气泡,滴定后气泡消失测得氨水的浓度偏高 |
| C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高 |
| D.滴定终点时俯视读数会导致测得氨水的浓度偏低 |
今年入冬以来,银川雾霾天气频繁出现,空气质量很差,严重影响市民的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM25的酸碱性为 ,试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0。若1mol空气含0.8molN2和0.2molO2,1300oC时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
2NO(g) △H>0。若1mol空气含0.8molN2和0.2molO2,1300oC时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,反应方程式为 。
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。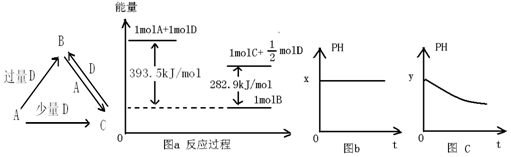
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为 。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为 。
②反应B+A→C的离子方程式为 。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D为 (填化学式),此时图b中x 7(填“﹥”“﹤”“﹦”)
②若图c符合事实,则其pH变化的原因是 (用离子方程式表示);已知图c中y﹤7,B的焰色反应为黄色,则B溶液中各离子浓度由大到小的顺序是 。
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式: 。
下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。

已知:298K时,Ksp[Cu(OH)2]=2.2×10-20, Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2] =1.9×10-13。
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)过量的还原剂应是 。
(3)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为
。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(4)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: ﹥ ﹥ 。(填金属阳离子)
(5)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L(用含Z的代数式表示);阳极产生的最后一种气体的反应式为 。