常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1)上述溶液中,可发生水解的是_______ _(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为__________。
(3)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值_______(填“增大”、“减小”或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
(5)取10 mL溶液③,然后加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________ 。
(15分)信息时代产生的大量电子垃圾对环境构成了威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: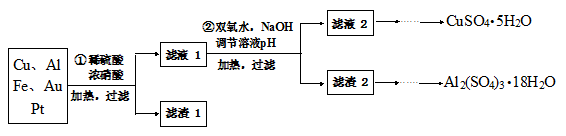
(1)第①步Cu与酸反应的离子方程式为 。
(2)第②步加H2O2的作用是 。
(3)该探究小组提出两种方案测定CuSO4·5H2O晶体的纯度。
方案一:取ag试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol·L-1Na2S2O3标准溶液滴定(原理为:I2+2S2O32-===2I-+S4O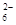 ),到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
),到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
①滴定过程中可选用 作指示剂,滴定终点的现象是 。
②CuSO4溶液与KI反应的离子方程式为 。
方案二:取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如:Cu2++H2Y2-=CuY2-+2H+。
③写出计算CuSO4·5H2O质量分数的表达式ω= 。
④下列操作会导致CuSO4·5H2O含量的测定结果偏高的是 。(填序号)
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
(1)20℃时0.1 mol·L-1NaOH分别滴定0.1 mol·L-1HCl、0.1 mol·L-1CH3COOH的pH变化曲线如下。
根据上述曲线回答下列问题:
①测得醋酸起点pH为3,则20℃时该浓度醋酸的电离度为 ;
②滴定开始后醋酸曲线变化比盐酸快的原因是 ;
(2)25 ℃时0.1 mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为 (填化学式)。
(3)下图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。
①下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 |
H2CO3 |
NH3·H2O |
| 电离平衡常数 |
Ka1=4.30×10-7 Ka2=5.61×10-11 |
1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,
用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(1)相同条件下,相等物质的量浓度的NH4Al(SO4)2中c(NH4+) (填“=”、“>”“<”)NH4HSO4中c(NH4+)。
(2)如图1是0.1mol•L﹣1电解质溶液的pH随温度变化的图象。
①其中符合0.1mol•L﹣1 NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②室温时,0.1mol•L﹣1 NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)= mol•L﹣1(填数值)
(3)室温时,向100mL 0.1mol•L﹣1 NH4HSO4溶液中滴加0.1mol•L﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液中,溶液的pH= 。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为 ,由水电离出的c(OH-)= mol·L-1。
(3)体积均为100 mL、pH均为2的盐酸与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
则HX是 (填“强酸”或“弱酸”),理由是 。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 |
电离常数(25 ℃) |
| HCN |
K=4.9×10-10 |
| CH3COOH |
K=1.8×10-5 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为 (填化学式)。
②25 ℃时,在0.5 mol/L 的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的 倍。
(1)25℃时,浓度为0.1 mol·L-1的6种溶液:
①HCl, ②CH3OOH, ③Ba(OH)2,④Na 2CO3,⑤KCl,⑥NH4Cl溶液
pH由小到大的顺序为_________________ _(填写编号)。
(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数
Kh= mol ·L-1(保留到小数点后一位)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈 (填“酸性”,“中性”或“碱性”),请写出离子浓度大小关系式: 。
(4)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+ c(CH3COOH)= ,m与n的大小关系是m n(填“>”“=”或“<”)。
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 ;B也必须添加温度控制装置,应该是 (选填“冰水浴”或“热水浴”)装置。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据下图所示的NaClO2的溶解度曲线,
请补充从NaClO2溶液中制得NaClO2的操作步骤:① ;② ;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2= Na2S4O6 + 2NaI)
①滴定过程中,至少须进行两次平行测定的原因是 。
②原ClO2溶液的浓度为 g / L(用步骤中的字母代数式表示)。
ⅠPM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5试样的pH 。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
则N2和O2反应生成NO的热化学反应方程式为
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下: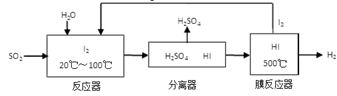
①用离子方程式表示反应器中发生的反应:
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_ _
Ⅱ铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
(1)检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
(2)将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
(3)由滤液B制备氯化铝晶体涉及的操作为: 蒸发浓缩、冷却结晶、 、洗涤。
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。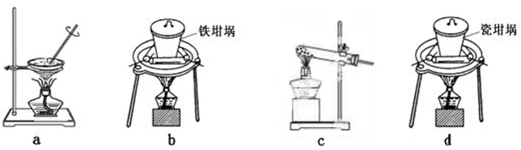
(12分)某科研小组在900℃的空气中合成出化学式为La2Ca2MnOx的超导体材料,其中La以+3价存在。为确定x的值,进行如下分析:
步骤1:准确称取0.5250g超导体材料样品,放入锥形瓶中,加25.00mL0.06000mol•L-1Na2C2O4溶液(过量)和25mL6mol•L-1HNO3溶液,在60-70℃下充分摇动,约半小时后得到无色透明溶液A(该条件下,只有Mn元素被还原为Mn2+,Na2C2O4被氧化为CO2)。
步骤2:用0.02000mol•L-1KMnO4溶液滴定溶液A至终点,消耗10.00mL KMnO4溶液。
(1)步骤1反应后溶液中Mn2+的物质的量浓度为0.02000mol•L-1。常温下,为防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范围为 [已知Mn(OH)2的Ksp=2.0×10-13]
(2)步骤2滴定终点的现象是 。
(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则所测x的值将 (填“偏大”、“偏小”或“不变”)。
(4)求x的值(写出计算过程)。
(16分)现有浓度均为0.1 mol·L-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________________________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是__________________________。
(3)已知T ℃,KW=1×10-13,则T ℃________25 ℃(填“>”、“<”或“=”)。在T ℃时将pH=11的NaOH溶液a L与pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________。
(4)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=________(填数据);
②若x+y=13,则a/b=________(填数据);
③若x+y>14,则a/b=________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为________(填表达式)。
下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t1 |
t2 |
| Kw/ mol2·L-2 |
1×10-14 |
a |
1×10-12 |
试回答以下几个问题:
(1)若25< t1< t2,则a 1×10-14(填“<”、“>”或“=”),由此判断的理由是:
。
(2)在t1℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为: 。
(3)在t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的硫酸溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 = ,此溶液中各种离子的浓度由大到小的顺序是 。
常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
| 实验编号 |
HA的物质的量浓度(mol·L-1) |
NaOH的物质的量浓度(mol·L-1) |
混合后溶 液的pH |
| 甲 |
0.1 |
0.1 |
pH=7 |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,判断HA是 (填“强酸”或“弱酸”)
某同学欲利用甲组中的一元酸HA溶液滴定未知浓度的NaOH溶液,可选取 作指示剂;在滴定过程中,下列哪些操作会使结果偏高的是
A.酸式滴定管未用标准酸HA润洗,直接装入标准酸HA
B.酸式滴定管滴定前有气泡,滴定后气泡消失
C.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥
D.读取酸HA体积开始时仰视读数,滴定结束后俯视读数
E.锥形瓶用蒸馏水洗净后,再用待测NaOH溶液润洗
(2)根据乙组数据分析,乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是
(4)分析丁组数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol·L-1。
某同学取丁组试剂各100mL,充分反应后测得放出的热量为Q,写出表示中和热的热化学方程式
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解,碘酸钾的溶解度随温度升高变化不大。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
(1)步骤②中氢氧化钾的主要作用是 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过 、过滤、洗涤、干燥等步骤。
(3)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取wg食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液滴定,消耗10.00mL时恰好反应完全。
①在滴定过程中,所用的玻璃仪器为 、 。
②该实验可以用 作指示剂,滴定终点的现象是 。
③下列有关该滴定实验的说法不正确的是 。
| A.滴定管在使用前必须检查是否漏水并润洗 |
| B.滴定时眼睛注视滴定管内溶液液面变化 |
| C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁 |
| D.终点读数时俯视会导致碘的含量偏低 |
④加碘食盐样品中的碘元素含量是 g·kg-1(以含w的代数式表示)。
二甲酸钾是一种白色晶体,商品名为弗米(Formil),是一种能替代抗生素的促生长剂,化学式为KH(HCOO)2,具有吸湿性,易溶于水。
二甲酸钾的生产工艺流程如下:
(1)写出甲酸和碳酸钾生产二甲酸钾的化学方程式: 。
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL。
①加入的指示剂是 (选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是 。
②上述弗米产品中二甲酸钾的质量分数为 。
常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。
回答下列问题:
(1)写出MOH的电离方程式: 。
(2)MOH与HA恰好完全反应时,溶液呈 性(填“酸”、“碱”或“中”),理由是(用离子方程式表示): ;此时,混合溶液中由水电离出的c(H+) 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)分别写出B、C两点,混合溶液中各离子浓度的大小关系
B点 ;
C点 。
(4)D点时,溶液中c(A-)+c(HA) 2 c(M+)(填“>”、“<”或“=”);若此时测得混合溶液的pH=3,则c(HA) + c(H+) = mol/L。