如图是在一定温度下,向不同电解质溶液中加入新物质时溶液的导电性能发生变化,其电流强度(I)随新物质加入量(m)的变化曲线,以下四个导电性实验,其中与A图变化趋势一致的是______,与B图变化趋势一致的是______,与C图变化趋势一致的是______。
①氢氧化钡溶液中滴入硫酸溶液至过量;
②醋酸溶液中滴入氨水至过量;
③澄清石灰水中通入CO2至过量
④氯化铵溶液中逐渐加入适量氢氧化钠固体
(1)对于可逆反应,升高温度,化学平衡向 热反应方向移动。
(2)对于有气体参加的可逆反应,增大压强,化学平衡向气体体积 (增大或小) 的方向移动。
(3)使用催化剂,能同等程度的改变正逆化学反应速率,化学平衡
(4)氢气的燃烧热为285.8千焦,其热化学方程式为:
(5)甲溶液的pH是4,乙溶液的pH是5,甲溶液与乙溶液的c(H+))之比:
已知水在25℃和95℃时,其电离平衡曲线如下图所示:
(1)则95℃时水的电离平衡曲线应为 (填“A”或“B”)。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,所得溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(3)95℃时,若1体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是(用含a、b的等式表示):
(1)常温下将0.2 mol•L-1 HCl溶液与0.2 mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2 mol•L-1HCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②混合溶液中c(Cl-)-c(M+)= mol•L-1。(填精确计算结果)
(2)常温下若将0.2 mol•L-1 MOH溶液与0.1 mol•L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,若溶液的pH不等于7,则混合溶液的pH 。(填“>7”、“<7”、或“无法确定”)
(4)用0.1000 mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 |
0.1000 mol•L-1 HCl溶液体积/mL |
待测NaOH溶液体积/mL |
| 1 |
27.83 |
20.00 |
| 2 |
25.53 |
20.00 |
| 3 |
27.85 |
20.00 |
①待测NaOH溶液的物质的量浓度为 mol•L-1。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是 。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.到达滴定终点时,仰视读数
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
在T℃下,某Ba(OH)2稀溶液中c(H+)=10-a mol/L,c(OH—)=10-b mol/L,已知a+b=12,向该溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如下表所示:
| 序号 |
氢氧化钡溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
8 |
| ② |
22.00 |
18.00 |
7 |
| ③ |
22.00 |
22.00 |
6 |
(1)依据题意判断,T℃ 25℃(填“大于”、“小于”或“等于”),该温度下水的离子积KW=
(2)x= 原Ba(OH)2稀溶液的物质的浓度为
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2稀溶液时,沉淀正好达到最大值,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为 ,Na2SO4的物质的量浓度为
用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.2000mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
| |
NaOH起始读数 |
NaOH终点读数 |
| 第一次 |
0.10mL |
18.60mL |
| 第二次 |
0.30mL |
18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.(保留四位有效数字)
(2)达到滴定终点的标志是
(3)以下操作造成测定结果偏高的原因可能是 。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
(1)常温下,0.05mol/L硫酸溶液中,c(H+)= mol/L,pH值为 ,水电离的c(H+)= mol/L。
(2)某温度,纯水中c(H+)=3×10-7mol/L,则纯水中c(OH-)= mol/L,此时在水加入稀硫酸至c(H+)为1×10-5mol/L则此时c(OH-)= mol/L
t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12。
(1)该温度下,水的离子积常数Kw= 。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH= ,此时该溶液中由水电离的c(OH-)= 。
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
(1)从能量角度看,断开化学键要 ,形成化学键要 ,一个化学反应是释放能量还是吸收能量取决于 ;水的分解需要吸收热量,试从化学键变化的角度分析原因 。
(2)4克硫粉完全燃烧时放出37kJ热量,该反应的热化学方程式是: 。
(3)现在下列物质:①100℃的纯水;②25℃0.1mol/LHCl溶液;③25℃0.1mol/LKOH溶液;④25℃0.1mol/LBa(OH)2溶液。
这些物质与25℃纯水相比,能促进水的电离的是 (填序号,以下同);
能抑制水的电离的是 ;
水电离的c(OH-)水等于溶液中c(OH-)的是 ;
水电离的c(H+)水等于溶液中c(H+)的是 ;
以上可得出一个结论,纯水中加入酸、碱,可 水的电离(填促进、抑制、不影响)
(1)配平氧化还原反应方程式:
________C2O42-+________MnO4-+________H+===________CO2↑+________Mn2++________H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25.00 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20.00 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为________________mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作______________(填“氧化剂”或“还原剂”),该滴定过程______________(填“需要”或“不需要”)另加指示剂。滴至16.00 mL时反应完全,此时溶液颜色由________变为__________。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果______________(填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果____________(填“偏大”、“偏小”或“无影响”)。
③原试样中H2C2O4·2H2O的质量分数为____________,KHC2O4的质量分数为______________。
(每空2分,共6分)
某温度下水的离子积为KW =1×10-13,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b= ;
(2)若所得混合液的pH=2,则a∶b= ;
(3)若所得混合液的pH=10,则a∶b= 。
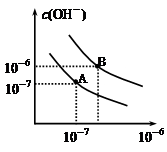
某温度(T ℃)下的溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:

(1)此温度下,水的离子积Kw为______________,则该温度T_____________25(填“>”、“< 或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
| 实验序号 |
Ba(OH)2溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
8 |
| ② |
22.00 |
18.00 |
7 |
| ③ |
22.00 |
22.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则a=_____________________,实验②中由水电离产生的c(OH-)=________________mol·L-1。
(3)在此温度下,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| |
甲 |
乙 |
丙 |
丁 |
| 0.1 mol·L-1 Ba(OH)2溶液体积/mL |
10 |
10 |
10 |
10 |
| 0.1 mol·L-1 NaHSO4溶液体积/mL |
5 |
10 |
15 |
20 |
①按丁方式混合后,所得溶液显________________(填“酸”、“碱”或“中”)性。
②写出按乙方式混合后,反应的离子方程式:_________________________。
③按甲方式混合后,所得溶液的pH为______________________。
已知醋酸是日常生活中常见的弱酸。
(1)用pH试纸测定醋酸pH的操作是__________________。
(2)常温下在pH=5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是__ mol·L-1。
(3)用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL某浓度的CH3COOH溶液,部分操作如下:
①取一支用蒸馏水洗净的碱式滴定管,加入标准氢氧化钠溶液,记录初始读数
②用酸式滴定管放出一定量待测液,置于用蒸馏水洗净的锥形瓶中,加入2滴甲基橙
③滴定时,边滴加边振荡,同时注视滴定管内液面的变化
请选出上述实验过程中的错误之处__________________(填序号)。上述实验与一定物质的量浓度溶液配制实验中用到的相同仪器是__________________。
按要求填空。
(1)某温度下,纯水中c (H+)=4.0×10-7 mol·L1,则此时c (OH-)= mol·L-1。若温度不变,滴入稀硫酸使c (H+)=8.0×10-6 mol·L1,则c (OH-) = mol·L-1。
(2)某温度时,水的离子积常数KW=10-12,则该温度_______(选填“大于”“小于”或“等于”)25℃。若将此温度下pH=10的NaOH溶液aL与pH=1的稀硫酸bL混合,(设混合后溶液体积的微小变化忽略不计),若所得混合液为中性,则a:b=_______;若所得混合液pH=2,则a:b=_______。