某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:
(1)该温度下水的离子积为 。
(2)该温度下0.01 mol/L的NaOH溶液pH为 。
常温下,有pH = 12的NaOH溶液100 mL,欲使它的pH降为11。
(1)如果加入蒸馏水,就加入________ mL (忽略密度差别,下同)
(2)如果加入pH = 10的NaOH溶液,应加入_________ mL
(3)如果加入0.008 mol/L HCl溶液,应加入__________ mL
列式并计算下列各小题:
(1)某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合溶液为中性,且a=12,b=2,求Va∶Vb。
②若所得混合溶液的pH=10,且a=12,b=2,求Va∶Vb。
有pH为13的Ba(OH)2、NaOH的混合溶液100 mL,从中取出25 mL用0.025 mol/L H2SO4滴定,当滴至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半。求:原混合溶液中Ba(OH)2的物质的量浓度
某温度下,纯水电离出的c(H+)=2×10—7mol/L。
(1)该温度下,0.1mol/L 盐酸的PH= ,0.1mol/L NaOH溶液中的c(H+)=
(2)该温度下,pH=13的NaOH溶液中的c(OH—)是pH=11的NaOH溶液中的c (OH—)的 倍,若将两者以等体积混合,所得溶液pH值为 。(lg2=0.3,lg3=0.5,lg5=0.7)
(3)该温度下,等物质的量浓度的NaOH溶液与盐酸按3∶2体积比混合(不考虑混合时的体积变化),所得溶液的pH值为12,它们的浓度为 。
某温度(t ℃)时,水的离子积为Kw=1×10-13。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比。
(1)若所得混合溶液为中性,则a∶b=__________;此溶液中各种离子的浓度由大到小的排列顺序是
______________________________________________________________。
(2)若所得混合溶液的pH=2,则a∶b=_____________。
(1) 常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-) / c(H+)=1×10-8。
①常温下,0.1 mol·L-1 HA溶液的pH= ;写出该酸(HA)与NaOH溶液反应的离子方程式: ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是: 。
(2) 常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH 14-a(>、<、=)
(3) 向物质的量浓度均为0.01mol·L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是 ,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+) 。(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
(4)设Ka、Kh、Kw分别表示CH3COOH的电离平衡常数、CH3COO-的水解平衡常数和水的离子积常数,则三者之间的关系为:
CuSO4溶液与K2C2O4溶液反应,得到一种蓝色结晶水合物晶体。通过下述实验确定该晶体的组成:
①称取0.1680g晶体,加入过量的H2SO4溶液,使样品溶解后加入适量水,加热近沸,用0.02000mol·L-1KMnO4溶液滴定至终点(溶液变为浅紫红色),消耗20.00mL。
②接着将溶液充分加热,使浅紫红色变为蓝色,此时MnO—4转化为Mn2+并释放出O2。
③冷却后加入2g KI固体(过量)和适量Na2CO3,溶液变为棕色并生成沉淀。
④用0.05000mol·L-1Na2S2O3溶液滴定,近终点加指示剂,滴定至终点,消耗10.00mL。
已知:2MnO—4+5H2C2O4+6H+==2Mn2++10CO2↑+8H2O
2Cu2++4I—=2CuI↓+I2
2Na2S2O3+I2=2NaI+Na2S4O6
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中加入的指示剂为 。
(3)通过计算写出蓝色晶体的化学式(写出计算过程)。
污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2H2DZ Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式:_____________________。萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,其后果是___________________________。
(2)如图是用双硫腙(HzDz)~CCl4络合萃取某些金属离子的酸度曲线,它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式萃取分离的百分率。
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~ CCl4络合萃取法处理废水。
①欲完全将废水中的Hg2+分离出来,须控制溶液的pH=________。
②当调节pH=2时,铋(Bi)的存在形式有_________________。
(3)污水中的亚汞离子(Hg2+ 2)必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化(Hg2+ 2),写出该反应的化学方程式:________________________。
(l)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1 NaOH溶液等体积混合,测得混合液的pH=8。混合液中由水电离出的OH-浓度与0.1mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为 。
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的①0.1mol·L-1硫酸铝溶液
②0.1mol·L-1氯化钡溶液③蒸馏水④0.1mol·L-1硫酸溶液中,Ba2+浓度由大到小的顺序是 。(用序号填写)
(3)常温下,将a mol·L-1的氨水与0.1mol·L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数 = mol·L-1。
= mol·L-1。
亚憐酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3。
(1)PCl3水解可制取亚磷酸:PCl3+3H2O=H3PO3+_______。
(2)H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3-。
H++H2PO3-。
①某温度下,0.10mol•L-1的 H3PO3溶液 pH =1.6,即溶液中c(H+) =2.5×10-2 mol•L-1。求该温度下上述电离平衡的平衡常数K,写出计算过程。(H3PO3的第二步电离忽略不计,结果保留两位有效数字。)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH________7 (填“>”、“=”或“<”)。
(3)亚磷酸具有强还原性,可使碘水褪色。该反应的化学方程式为_______。
(4)电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如下:
①阴极的电极反应式为____________________________。
②产品室中反应的离子方程式为_____________________。
目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l)
2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) △H=" +1530.0kJ" /mol。
4NH3(g)+3O2(g) △H=" +1530.0kJ" /mol。
(1)氢气的燃烧热△H=_______________kJ/mol。
(2)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是 。
| A.气体体积不再变化,则已平衡 |
| B.气体密度不再变化,尚未平衡 |
| C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动 |
| D.平衡后,压缩装置,生成更多NH3 |
(3)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如下。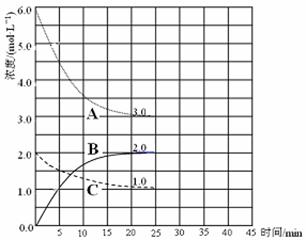
① 表示N2浓度变化的曲线是 。
② 前25 min 内,用H2浓度变化表示的化学反应速率是 。
③ 在25 min末刚好平衡,则平衡常数K = 。
(4)在第25 min 末,保持其它条件不变,升高温度,在第35 min末再次平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(5)已知常温下,NH4+ 的水解常数为1.0×10-9,则0.1mol/L NH4Cl溶液pH= 。(忽略NH4+水解对NH4+浓度的影响)
⑴ 某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mg Mg2+, Mg2+的物质的量浓度为多少?⑵ 在KCl和CaCl2所组成的某混合物中,K+与Ca2+的物质的量之比为2:1,则KCl与CaCl2的物质的量之比为多少?该混合物中的CaCl2的质量分数为多少?
标准状况下,一个装满O2的容器的质量为79g,若装满氮气时质量是71g,盛满某气体X时,质量为103g。试计算:
⑴此容器的容积
⑵气体X的相对分子质量。
⑶该状况下该容器中盛满氯气时的总质量。