25℃时,向V mL pH=a的盐酸中,滴加10V mL pH=b的NaOH溶液,所得溶液中Cl-的物质的量恰好等于Na+的物质的量,则a+b的值是
| A.15 | B.14 | C.13 | D.不能确定 |
25℃时,若体积为V1、pH=a的某一元强酸与体积为V2、pH=b的某一元强碱混合恰好完全中和,且已知V1︰V2<1,a=0.5b则关于a的判断正确的是:
| A.a可能为6 | B.a可能为5 |
| C.a可能为4 | D.a可能为3 |
在常温下,将pH=11的某碱溶液和pH=3的某酸溶液等体积混合后,下列说法不正确的是
| A.若所得溶液呈中性,则生成的盐可能为强酸强碱盐 |
| B.若所得溶液呈碱性,则一定是强碱与弱酸溶液反应 |
| C.若所得溶液呈酸性,则可能是弱酸与强碱溶液反应 |
| D.若所得溶液的pH=9,则水电离产生的c(OH-)可能为10-9mol/L |
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:
①1×10-3 mol·L-1的氨水b L
②c(OH-)=1×10-3 mol·L-1的氨水c L
③c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L
其中a、b、c、d的关系正确的是( )
| A.b>a=d>c | B.a=b>c>d |
| C.a=b>d>c | D.c>a=d>b |
25℃时,有下列四种溶液:①0.1mol/L的CH3COOH溶液;②pH=13的NaOH溶液;③0.05mol/L的H2SO4溶液;④0.1mol/L的Na2CO3溶液。则下列有关说法中正确的是( )
A.溶液④显碱性,用离子方程式解释其原因可表示成:CO32-+2H2O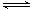 H2CO3+2OH- H2CO3+2OH- |
| B.在上述四种溶液中,pH由大到小的顺序为:②④①③ |
| C.将该温度下amL的溶液②与bmL的溶液③混合,所得混合溶液的pH=7,则a:b=1:2 |
| D.若将溶液④和Al2(SO4)3溶液混合,一定可观察到有白色胶状沉淀和无色气体生成 |
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是
A.若a=b,则c(NH )=c(Cl-) )=c(Cl-) |
B.若a>b,则c(NH )>c(Cl-) )>c(Cl-) |
| C.若a>b,则c(OH-)>c(H+) | D.若a<b,则c(OH-)<c(H+) |
下列各表述与示意图一致的是
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定10 mL 0.05 mol·L-1 Ba(OH)2溶液,溶液的pH随加入酸体积的变化 |
| B.图②表示充有NO2的恒温密闭容器在t时刻增大压强时,c(NO2)随时间的变化 |
C.图③中曲线表示反应N2 (g) +3 H2(g) 2NH3(g) ΔH < 0 ,正、逆反应的平衡常数K随温度的变化 2NH3(g) ΔH < 0 ,正、逆反应的平衡常数K随温度的变化 |
D.图④中a、b曲线分别表示反应2SO2(g) + O2(g) 2SO3(g) ΔH<0使用(a)和未使用(b)催化剂时,反应过程中的能量变化 2SO3(g) ΔH<0使用(a)和未使用(b)催化剂时,反应过程中的能量变化 |
液氨与水的电离相似,存在微弱的电离:NH3+NH3 NH4++NH2-。对该体系的说法中错误的是
NH4++NH2-。对该体系的说法中错误的是
| A.液氨中c(NH4+)与c(NH2—)的乘积为一常数 |
| B.液氨电离达到各微粒的浓度保持不变 |
| C.只要不加入其它物质c(NH4+)=c(NH2-) |
| D.液氨中存在NH3、NH4+、NH2-、H2O、NH3·H2O等粒子。 |
常温下下列各组离子在指定溶液中能大量共存的是( )
| A.pH=1 的溶液中:Fe2+、NO-3、SO24-、Na+ |
| B.由水电离出的 c(H+)=1×10-14mol/L 的溶液中:Ca2+、Cl-、HCO-3、K+ |
| C.c(H+)/c(OH-)=1×1012的溶液中:NH+4、Cl-、NO-3、Al3+ |
| D.c(Fe3+)=0.1mol/L 的溶液中:K+、ClO-、SO42-、SCN- |
一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
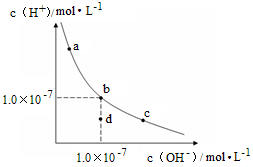
| A.升高温度,可能引起由c向b的变化 |
| B.该温度下,水的离子积常数为1.0×10-13 |
| C.该温度下,加入FeCl3可能引起由b向a的变化 |
| D.该温度下,稀释溶液可能引起由c向d的变化 |
常温下,下列各组离子在相应的条件下可能大量共存的是
| A.能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+ |
B.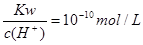 的溶液中:Na+、HCO3-、Cl-、K+ 的溶液中:Na+、HCO3-、Cl-、K+ |
| C.在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3- |
| D.由水电离产生的c(OH-)=1×10-12mol/L的溶液中:NO3-、Mg2+、Na+、SO42- |
用滴定法测定Na2CO3(含NaCl杂质)的质量分数,下列操作会引起测定值偏高的是( )
| A.试样中加入酚酞作指示剂,用标准酸液进行滴定 |
| B.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定 |
| C.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行测定 |
| D.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定 |
40℃时,在氨-水体系中不断通入CO2,各种离子变化趋势如下图所示。下列说法不正确的是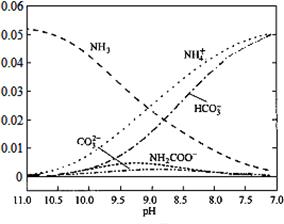
| A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) |
| B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ) |
C.随着CO2的通入,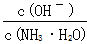 不断增大 不断增大 |
| D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 |
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )

| A.a点由水电离出的c(H+)=1.0×10-14mol•L-1 |
| B.b点:c(NH4+)+c(NH3•H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH4+) |
| D.d点后,容易温度略下降的主要原因是NH3•H2O电离吸热 |
下列有关说法不正确的是
A.将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性
B.上图可表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
C.25℃时,pH=2的1.0 L 醋酸溶液中水电离出的H+的数目为10-12NA
D.某吸热反应能自发进行,则该反应一定是熵增的反应