浓度均为0.10mol/L、体积均为v0的MOH和ROH溶液,分别加水稀释至体积v,pH随 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当 =2时,若两溶液同时升高温度, 则c(M+)/c(R+)增大 =2时,若两溶液同时升高温度, 则c(M+)/c(R+)增大 |
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
| A.水的电离程度始终增大 |
| B.c(NH4+)/c(NH3·H2O)先增大再减小 |
| C.c(CH3COOH)与c(CH3COO-)之和始终保持不变 |
| D.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-) |
一只规格为a mL的滴定管,其尖嘴部分充满溶液,管内液面在m mL处,当液面降到n mL处时,下列判断正确的是( )
| A.流出溶液的体积为(m-n) mL | B.流出溶液的体积为(n-m) mL |
| C.管内溶液体积等于(a-n) mL | D.管内溶液体积多于n mL |
现有0.4 mol·L-1HA溶液和0.2 mol·L-1NaOH溶液等体积混合组成的混合溶液。下列有关推断正确的是
A.若HA的电离能力大于A-的水解能力,则有c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
B.若A-的水解能力大于HA的电离能力,则有c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+)
C.无论该溶液呈酸性还是碱性,都有c(Na+)+c(H+)=c(A-)+c(OH-)
D.无论该溶液呈酸性还是碱性,都有c(Na+)=c(A-)+c(HA)
常温下,下列混合溶液的pH一定大于7的是
| A.0.01mol/L的盐酸和0.01mol/L的NaOH溶液等体积混合 |
| B.pH=3的盐酸和pH=11的氨水溶液等体积混合 |
| C.0.01mol/L的盐酸和0.01mol/L的氨水溶液等体积混合 |
| D.pH=3的醋酸和pH=11的NaOH溶液等体积混合 |
下列有关说法正确的是
| A.催化剂可以加快化学反应速率,也能增大化学反应的焓变 |
| B.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
C.25 ℃下,在NH3·H2O稀溶液中加水稀释, 的值不变 的值不变 |
| D.在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-电离程度减小 |
已知HCN的电离常数K=6.2×10﹣10。用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,经测定溶液呈碱性.则下列关系式正确的是( )
| A.c(CN﹣)>c(Na+) | B.c(CN﹣)>c(HCN) |
| C.c(HCN)+c(CN﹣)=0.2mol·L﹣1 | D.c(CN﹣)+c(OH﹣)="0.1" mol·L﹣1 |
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当 =2时,若两溶液同时升高温度则 =2时,若两溶液同时升高温度则 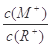 增大 增大 |
25℃时,浓度为0. 1mol/L的某一元强碱MOH溶液与相同体积的某一元酸HA溶液混合后恰好呈中性。下列判断一定正确的是
| A.HA酸溶液的pH值一定等于1 |
| B.HA酸溶液的物质的量浓度一定等于0.1mol/L |
| C.中和后溶液中M+离子浓度一定等于A-离子浓度 |
| D.中和后生成的盐MA一定没有发生水解 |
常温下,用0.01mol·L-1NaOH溶液滴定20.00mL0.01mol·L-1CH3COOH溶液,所得滴定曲线如右图。下列说法正确的是
| A.a点对应溶液的pH=2 |
| B.b点对应的溶液中:c(OH-)+c(CH3COO-)=c(Na+)+c(H+) |
| C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应 |
| D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度 |
现有体积相同、pH均为2的盐酸和醋酸,下列叙述错误的是
| A.盐酸溶液中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等 |
| B.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| C.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-) |
| D.它们分别与足量CaCO3反应时,放出的CO2一样多 |
燃烧含硫高的煤和石油是形成酸雨的重要原因,现取放置一段时间的雨水,经分析测得除H+外的各离子浓度为:c(NH4+)=2×10-5mol/L,c(Cl-)=6×10-5mol/L ,c(Na+)=1.9×10-5mol/L ,c(NO3-)=2.3×10-5mol/L, c(SO42-)=2.8×10-5mol/L,则此次酸雨的pH为
| A.3 | B.4 | C.5 | D.6 |
下表中实验操作、现象和所得出的结论均正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋, |
红色很快褪为无色 |
随溶液pH减小,NaClO的氧化能力增强 |
| B |
向氯化亚铁溶液中加入Na2O2粉末, |
出现红褐色沉淀 |
说明原氯化亚铁己氧化变质 |
| C |
苯酚和水的浊液中,加Na2CO3溶液, |
溶液变澄清 |
苯酚的酸性比碳酸强 |
| D |
向溶液X中加入NaHCO3粉末, |
产生无色气体 |
溶液X的溶质一定属于酸 |
在下列的各种叙述中,正确的是( )
| A.在任何条件下,纯水的pH=7 | B.在任何条件下,纯水都呈中性 |
| C.在100℃时,纯水的pH>7 | D.在100℃时,纯水中c(H+)<10-7mol/L |