25 ℃时,0.1 mol·L-1的盐酸中,水的离子积为( )
| A.1×10-13 | B.1×10-15 | C.1×10-14 | D.5×10-12 |
将pH=2的H2SO4与pH=13的NaOH混合,当混合液的pH=11时,NaOH溶液与硫酸溶液的体积比是( )
| A.11∶1 | B.9∶1 |
| C.1∶11 | D.1∶9 |
一定温度下,取pH=12的NaOH溶液和氨水各10 mL,分别用蒸馏水冲稀至1 L。关于稀释后的溶液的pH的说法正确的是( )
| A.NaOH溶液的pH大于氨水的pH |
| B.NaOH溶液的pH小于氨水的pH |
| C.两溶液的pH相等 |
| D.无法判别两溶液pH的相对大小 |
25 ℃时,向c mL pH=a的盐酸中滴加pH="b" 的NaOH溶液10 c mL,溶液中Cl-的物质的量恰好等于加入Na+的物质的量,则此时a+b的值为( )
| A.13 | B.14 |
| C.15 | D.无法确定 |
把99.5 mL 0.1 mol·L-1 NaOH溶液加到100.5 mL pH=1的H2SO4溶液中,所得溶液的pH为( )
| A.2.7 | B.3 |
| C.3.3 | D.11.3 |
等量苛性钠溶液分别用pH为3和4的醋酸中和,设消耗醋酸的体积依次为Va和Vb,则两者的关系正确的是( )
| A.Va>10Vb |
| B.Vb=10Va |
| C.Vb<10Va |
| D.Vb>10Va |
用1.0 mol·L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图3-5所示。原硫酸溶液的物质的量浓度和反应后溶液的总体积是( )
图3-5
| A.1 mol·L-1,60 mL |
| B.0.5 mol·L-1,80 mL |
| C.0.5 mol·L-1,40 mL |
| D.1 mol·L-1,80 mL |
下列物质加入水中,能使水的电离程度增大,且所得溶液显酸性的是( )
| A.CH3COOH |
| B.Al2(SO4)3 |
| C.NaOH |
| D.Na2CO3 |
常温下,下列溶液pH=2的是( )
| A.0.01 mol·L-1 CH3COOH溶液 |
| B.10-3 mol·L-1 H2SO4浓缩到原体积的110. |
| C.pH=1的H2SO4溶液稀释10倍 |
| D.c(OH-)=10-2 mol·L-1的某溶液 |
有甲、乙两种溶液,甲溶液的pH是乙溶液的pH的2倍,则甲溶液中c(H+)与乙溶液中c(H+)的关系是( )
| A.2∶1 |
| B.100∶1 |
| C.1∶100 |
| D.无法确定 |
下列在指定溶液中的各组离子,能够大量共存的是( )
A.无色溶液中: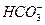 、Na+、Cl-、OH- 、Na+、Cl-、OH- |
B.pH=11的溶液中:S2-、K+、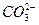 、Cl- 、Cl- |
C.pH=1的溶液中:Fe2+、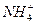 、Mg2+、 、Mg2+、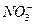 |
D.水电离的c(H+)=10-12 mol·L-1的溶液中:Fe3+、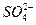 、K+、SCN- 、K+、SCN- |
在常温下,把醋酸滴入NAOH溶液中,当测得溶液中的C(NA+)=C(CH3COO-)时,此时混合物的pH为( )
| A.大于7 | B.等于7 | C.小于7 | D.只能用pH试纸来测定 |
常温下下列四种溶液,由水电离生成的H+的物质的量浓度之比为( )
①pH=0的盐酸 ②0.1 mol·L-1的盐酸 ③0.01 mol·L-1的NAOH溶液 ④pH=11的NAOH溶液
| A.1∶10∶100∶1000 | B.0∶1∶12∶11 |
| C.14∶13∶12∶11 | D.14∶13∶2∶1 |