水溶液中的行为是中学化学的重要内容。
(1)25 ℃时,某溶液中由水电离出c(H+)=1×10-10 mol/L,该溶液pH为_______________。
(2)25 ℃时,测得亚硫酸氢钠溶液的pH<7,解释该溶液显酸性的原因(用离子方程式表示,并作适当解释) 。
(3)电离常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 |
电离常数(25 ℃) |
| HCN |
K=4.9×10-10 |
| HClO |
K=3×10-8 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
25 ℃时,将浓度相同的四种盐溶液:① NaCN ② NaClO ③ Na2CO3 ④ NaHCO3,按pH由大到小的顺序排列 (填序号),向84消毒液中通入少量的CO2,该反应的化学方程式为 。
(4)25 ℃时,将n mol·L-1的氨水与0.2mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_______________性(填“酸”、“碱”或“中”), NH3·H2O的电离常数Kb=_____________(用含n的代数式表示)。
已知硫酸在水中的电离方程式是:H2SO4 = H+ + HSO4— HSO4— H++SO42—,回答下列问题:
H++SO42—,回答下列问题:
(1)Na2SO4溶液显 (填“酸性”,“中性”或“碱性”)。理由是(用离子方程式表示) 。
(2)在0.1 mol·L-1的Na2SO4溶液中,下列微粒浓度关系正确的有 。
| A.c(SO42—)+c(HSO4—)+c(H2SO4)="0.1" mol·L-1 |
| B.c(OH-)=c(H+)+c(HSO4—) |
| C.c(Na+)+c(H+)=c(OH-)+c(HSO4—)+2c(SO42—) |
| D.c(Na+)=2c(SO42—)+2c(HSO4—) |
(3)如果25 ℃时,0.1 mol·L-1的NaHSO4溶液中c(SO42—)="0.029" mol·L-1,则0.1 mol·L-1H2SO4溶液中c(SO42—) 0.029 mol·L-1(填“<”,“>”或“=”),理由是 。
(4)0.1 mol·L-1NaHSO4溶液中各种离子浓度由大到小的顺序是: 。
(5)如果25 ℃时,0.10 mol·L-1H2SO4溶液的pH="-lg" 0.11, 则25 ℃时,0.10 mol·L-1的H2SO4溶液中c(SO42—)= 。
某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________。直到_________ _
( 2)下列说法中正确的有
A.滴定管主要用来精确地放出一定体积的溶液
B.碱性溶液和强氧化性溶液应该选择碱式滴定管
C.滴定管润洗的方法是从上口将所要盛装的溶液装满,在从下口将液体放入预置的烧杯中
D.排出碱式滴定管尖嘴部分气泡的方法是打开活塞快速放液以赶走气泡
E.本实验中待测的氢氧化钠溶液需要用量筒来量取
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处。
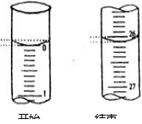
| 滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol/L盐酸的体积(mL)] |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
|
|
|
| 第二次 |
25.00 |
1.56 |
28.08 |
26.52 |
| 第三次 |
25.00 |
0.22 |
26.34 |
26.12 |
(5)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
常温下,将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:
①1×10-3 mol·L-1的氨水b L
②c(OH-)=1×10-3 mol·L-1的氨水c L
③c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L其中a、b、c、d的关系正确的是
| A.a=b>d>c | B.a=b>c>d | C.b>a=d>c | D.c>a=d>b |
在T ℃时, Ba(OH)2的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=4的盐酸,测得混合溶液的部分pH如下表所示:
| 序号 |
氢氧化钡溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
8 |
| ② |
22.00 |
18.00 |
c |
| ③ |
22.00 |
22.00 |
d |
假设溶液混合前后的体积变化可忽略不计,则下列说法不正确的是
A.a = 8 B.b = 4 C.c = 5 D.d = 6
室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00ml 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )

| A.II表示的是滴定醋酸的曲线 |
| B.V(NaOH) =20.00ml时,两份溶液中c(Cl—)=c(CH3COO—) |
| C.pH=7时,滴定醋酸消耗V(NaOH)小于20ml |
| D.V(NaOH) =10.00ml时,醋酸溶液中: 2c(OH—)-2 c(H+ )= c(CH3COO—)- c(CH3COOH) |
(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释至100mL,稀释后的溶液中c(H+)/c(OH-)=___________________。
(2)某温度时,测得0. 01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数KW=_______。该温度___________25℃。
(3)在(2)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va:Vb=____________
②若所得混合液的州pH=10,且a=12,b=2,则Va:Vb=____________
液氨与水性质相似,也存在微弱的电离:2NH3 NH4++NH2-,其离子积常数K=c(NH4+)·c(NH2-)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
NH4++NH2-,其离子积常数K=c(NH4+)·c(NH2-)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
| A.液氨的电离度 | B.液氨的离子积常数 |
| C.c(NH4+) | D.c(NH2-) |
为了测定草酸晶体(H2C2O4·xH2O)中的x值,进行如下实验:
①称取Wg草酸晶体,配成100.00mL溶液。
②取25.00mL所配溶液于锥形瓶内,加入适量稀H2SO4,用amol/L KMnO4溶液滴定。
试回答:
(1)写出滴定过程中反应的化学方程式: 。
(2)实验中,标准液KMnO4应装在 (填“酸式”或“碱式”)滴定管中。滴定终点时溶液由 色变为 色,且在30s内颜色不再恢复为原来颜色。
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得的x值会 (填“偏大”、“偏小”或“无影响”)。
(4)在滴定过程中若用去amol/L KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为 mol/L,由此x= 。
室温下,取溶质的物质的量浓度相同的NaOH溶液和HCl溶液,以体积比3:2相混合,所得溶液的pH=12,则原溶液中溶质的物质的量浓度为
| A.0.01mol/L | B.0.017mol/L | C.0.50mol/L | D.0.05mol/L |
中学化学实验,淡黄色的pH试纸常用于测定溶液的酸碱性。在25 ℃,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色。而要精确测定溶液的pH,需用pH计。pH计主要通过测定溶液中H+浓度来测定溶液的pH。
(1)已知水中存在如下平衡H2O  H++OH- ΔH>0。现欲使平衡向右移动,且所得溶液呈中性,选择的方法是 (填字母)。
H++OH- ΔH>0。现欲使平衡向右移动,且所得溶液呈中性,选择的方法是 (填字母)。
| A.向水中加入NaHSO4溶液 |
| B.向水中加入Cu(OH)2固体 |
| C.加热水至100 ℃[其中c(H+)="1×10-6" mol·L-1] |
| D.在水中加入H2SO4溶液 |
(2)现欲测定100 ℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显 色,若用pH计测定,则pH 7(填“>”“<”或“=”),溶液呈 性(填“酸”“碱”或“中”)。
(3)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是 (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
某温度(T ℃)下的溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:

(1)此温度下,水的离子积Kw为________,则该温度T______25(填“>”、“<”或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
| 实验序号 |
Ba(OH)2溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
8 |
| ② |
22.00 |
18.00 |
7 |
| ③ |
22.00 |
22.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则a=________,实验②中由水电离产生的c(OH-)=______mol·L-1。
(3)在此温度下,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| |
甲 |
乙 |
丙 |
丁 |
| 0.1 mol·L-1 Ba(OH)2溶液体积/mL |
10 |
10 |
10 |
10 |
| 0.1 mol·L-1 NaHSO4溶液体积/mL |
5 |
10 |
15 |
20 |
①按丁方式混合后,所得溶液显________(填“酸”、“碱”或“中”)性。
②写出按乙方式混合后,反应的离子方程式:________________________。
③按甲方式混合后,所得溶液的pH为__________。
常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合,测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示): .
(2)混合溶液中由水电离出的c(H+) 0.1mol/LNaOH溶液中由水电离出的c(H+)(填“>”、“<”或“=”).
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)﹣c(A﹣)= mol/L,c(OH﹣)﹣c(HA)= mol/L.
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断
(NH4)2CO3溶液的pH 7(填“大于”、“小于”或“等于”).
(5)将同温度下等浓度的四种盐溶液:A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl,按pH由大到小的顺序排列是: (填序号).
25℃时,Kw=1.0×10﹣14;100℃时,Kw=5.5×10﹣13.下列说法正确的是( )
| A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7 |
| B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7 |
| C.25℃时,0.2 mol/L NaOH溶液与0.2 mol/L CH3COOH恰好中和,所得溶液的pH=7 |
| D.25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7 |