用0.1000mol·L-1标准NaOH溶液测定食醋中醋酸的含量,下列说法正确的是( )
| A.酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2~3次 |
| B.应该选择酚酞作指示剂 |
| C.滴定过程中眼睛应始终注视滴定管内液面变化 |
| D.读取标准液的刻度时,滴定前平视,滴定后仰视,测定结果偏低 |
用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )
| A.配制标准溶液的固体KOH中混有NaOH杂质 |
| B.滴定终点读数时,仰视滴定管的刻度,其他操作正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 |
| D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
己知lg2="0.3" ,lg5 =" 0.7" ,某温度(t℃)时,测得0.0lmol/L的NaOH溶液的pH="11" 。在此温度下,将60mLpH=1的H2SO4溶液与40mL0.1mol/L的Ba(OH)2溶液混合(忽略溶液混合体积的变化),所得溶液的pH为( )
| A.12.3 | B.11.7 | C.11.3 | D.12.7 |
(原创) 25℃时,向V mL PH= a的稀硫酸中,滴加10V mL pH=b的NaOH溶液,所得溶液中2c( SO42— ) = c(Na+),则a+b的值是
| A.13 | B.14 | C.15 | D.不能确定 |
25℃时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表,下列判断不正确的是( )

A.X>0.05
B.将实验①所得溶液加水稀释后,c(OHˉ )/c(A-)变大
C.实验①所得溶液c(A-)+c(HA)=0.10mol·L-1
D.实验②所得溶液: c(Na+)+c(OH-)= c(A-)+c(H+)
下图是用0.1000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
(1)仪器A的名称____________;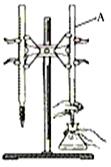
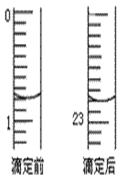
(2) 盐酸的体积读数:滴定前读数为_________mL,滴定后读数为____________ mL;
(3)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的浓度是___________________(保留四位有效数字) ;
| 实验 编号 |
待测NaOH溶液 的体积(mL) |
滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
| 1 |
20.00 |
1.20 |
23.22 |
| 2 |
20.00 |
2.21 |
24.21 |
| 3 |
20.00 |
1.50 |
23.48 |
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00 mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是______________________________(用序号字母填写);
(5)判断到达滴定终点的实验现象是_______________________________。
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
① 如果上述B步骤省略,对测定结果的影响是_____________________ ;
②标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是_______________。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
① 将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
② 将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③ 向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂恰好变色,且30分钟不变化,测得所耗盐酸的体积为V1mL;
④ 重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从___________色变为___________色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察___________;
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是______________________,由此造成的测定结果____________ (填偏高、偏低或无影响);
(4)步骤②缺少的操作是__________________ ;
(5)右图,是某次滴定时的滴定管中的液面,其读数为__________mL;

(6)根据下列数据:
| 滴定次数[ |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度为___________mol/L
某次酸雨分析数据如下:C(NH4+)=2.0×10-5mol/L, C(Cl-)=6.0×10-5mol/L, C(SO42-)=2.8×10-5mol/L C(NO3-)=2.3×10-5mol/L C(Na+)=1.9×10-5mol/L,据此计算此次酸雨的pH大约为( )
| A.3 | B.4 | C.5 | D.6 |
某溶液中由水电离出来的C(OH—)=10-12mol/L,则该溶液中的溶质不可能是( )
| A.HCl | B.NaOH | C.NH4Cl | D.H2SO4 |
下列物质加入水中,能使水的电离程度增大,且所得溶液显酸性的是( )
| A.CH3COOH | B.Al2(SO4)3 | C.NaOH | D.Na2CO3 |
用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确的是( )
| A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸 |
| B.锥形瓶用蒸馏水洗净后,加入一定体积的未知浓度的NaOH溶液润洗 |
| C.滴定时,没有逐出滴定管下口的气泡 |
| D.读数时,视线与滴定管内液体的凹液面最低处保持水平 |
水的电离过程为H2O H++OH-,在不同温度下其离子积分别为Kw(250C)=1.0×10-14,Kw(350C)=2.1×10-14,则下列叙述正确的是( )
H++OH-,在不同温度下其离子积分别为Kw(250C)=1.0×10-14,Kw(350C)=2.1×10-14,则下列叙述正确的是( )
A.c(H+)随着温度的升高而降低
B.在350C时,纯水中c(H+)>c(OH-)
C.水的电离是一个吸热过程
D.水的电离常数Kw(250C)>Kw(350C)
下列说法正确的是
| A.润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 |
B.用惰性电极电解MgCl2溶液的离子方程式为:2Cl-+ 2H2O Cl2↑+ H2↑+ 2OH- Cl2↑+ H2↑+ 2OH- |
| C.为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵溶液和稀酸性高锰酸钾溶液,分别插入石墨棒用导线与电流计相连,然后用装有K2SO4饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色 |
| D.嫦娥三号月球车玉兔号在进入第二个月夜休眠前,出现了机构控制异常情况,其病因或为月尘,即月球上直径小于10微米的浮尘,月尘分散在空气中形成的分散系属于胶体。 |