常温下,在pH都等于9的NaOH溶液和CH3COONa两种溶液中,设由水电离产生OH-浓度分别为amol·L-1和bmol·L-1,则a和b的关系是:
| A.a>b | B.a=10-4b | C.b=10-4a | D.a=b |
常温下,两种酸的电离平衡常数如下表:
| 酸 |
电离常数K1 |
电离常数K2 |
| H2SO3 |
1.54×10-2 |
1.02×10-7 |
| H2CO3 |
4.3×10-7 |
5.6×10-11 |
常温下,浓度均为0.1 mol/L的下列溶液:①Na2SO3;②Na2CO3;③NaHSO3,下列有关说法正确的是
A.pH:Na2CO3溶液小于Na2SO3溶液
B.结合H+能力:CO32¯弱于SO32¯
C.NaHSO3溶液显酸性的原因是: NaHSO3="==" Na+ + H+ + SO32¯
D.①与②溶液等体积混合后的溶液中:c(SO32-) > c(CO32-) > c(HCO3-) > c(HSO3-)
当用碱滴定酸时,下列操作中可能使测定结果(酸的浓度)偏低的是
| A.滴定后读取标准液体积时仰视 |
| B.锥形瓶用蒸馏水洗后,未干燥 |
| C.碱式滴定管用蒸馏水洗后,未用标准液润洗 |
| D.滴定至溶液呈浅红色后,未等到半分钟立即开始读数 |
常温下,下列溶液中各离子浓度关系正确的是
| A.醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO—) |
| B.浓度为0.1 mol·L-1的碳酸钠溶液:c(Na+)=2c(CO32—)+c(HCO3—) +c(H2CO3) |
| C.pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl—)>c(NH4+)>c(H+)>c(OH—) |
| D.等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O) |
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是
| A.某温度下,测得溶液的pH < 7 |
| B.溶液中c(Na+)=c(A2-) |
| C.溶液中存在Na+、HA-、A2-、 H2A 多种微粒 |
| D.NaHA溶液可与等体积等物质的量浓度的NaOH溶液恰好反应 |
在25℃时将pH=11的NaOH 溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是
| A.c(Na+)=c(CH3COO﹣)+c(CH3COOH) |
| B.c(H+)=c(CH3COO﹣)+c(OH﹣) |
| C.c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+) |
| D.c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣) |
在一支25mL的酸式滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL刻度处若把滴定管内溶液全部放入烧杯中,再用0.1mol/L NaOH溶液进行中和,则所需NaOH溶液的体积
| A.大于20mL | B.小于20mL |
| C.等于20mL | D.等于5mL |
将0.2mol·L-1HA溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的
A.c (HA)<c (A-) B.c (Na+)="c" (A-)+c (HA)
C.c (HA)-c (A-)=c (OH-) D.c (HA)+c (A-)=0.1mol/L
常温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合。 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
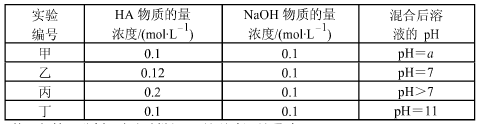
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?________________。
(2)乙组混合溶液中粒子浓度 c(A-)和 c(Na+)的大小关系_____________。
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是:___________
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=_______mol·L-1。
(5) 某二元酸(化学式用 H2B 表示)在水中的电离方程式是:
H2B===H++HB- HB- H++B2-
H++B2-
回答下列问题:
在 0.1 mol·L-1的 Na2B 溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
常温下,用0.01mol·L-1NaOH溶液滴定20.00mL0.01mol·L-1CH3COOH溶液,所得滴定曲线如右图。下列说法正确的是
| A.a点对应溶液的pH=2 |
| B.b点对应的溶液中:c(OH-)+c(CH3COO-)=c(Na+)+c(H+) |
| C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应 |
| D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度 |
下列关于pH变化的判断正确的是
| A.温度升高,Na2CO3溶液pH减小 |
| B.氢氧化钠溶液久置于空气中,溶液pH变大 |
| C.新制氯水经光照一段时间后,溶液pH减小 |
| D.温度升高,纯水pH增大 |
将纯水加热至较高温度,下列叙述正确的是
| A.水的离子积变大、pH变小、呈酸性 |
| B.水的离了积不变、pH不变、呈中性 |
| C.水的离子积变小、pH变大、呈碱性 |
| D.水的离子积变大、pH变小、呈中性 |
用pH试纸测定某无色溶液的pH值时,规范的操作是( )
| A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较; |
| B.将溶液倒在pH试纸上,跟标准比色卡比较; |
| C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较; |
| D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较; |
某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如图所示。

已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.34 |
9.7 |
| Fe3+ |
1.48 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
请回答下列问题:(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的 (填序号)作为试剂甲是比较合适的。
A.KMnO4 B.HNO3 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH生成Fe(OH)3反应的离子方程式 。
(5)298K时残留在乙溶液中的c(Fe3+)在 mol/L以下。Fe(OH)3的KSP= 2.70×10-39
(6)乙的溶液可直接用作氮肥,则乙的化学式是 。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式