催化重整不仅可以得到合成气(CO和
)。还对温室气体的减排具有重要意义。回答下列问题:
(1) 催化重整反应为: 。
已知:
该催化重整反应的 ________ 。有利于提高 平衡转化率的条件是________(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2L的容器中加入 以及催化剂进行重整反应。达到平衡时 的转化率是50%,其平衡常数为________ 。
(2)反中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
| |
积碳反应
|
消碳反应
|
|
|
|
75 |
172 |
|
| 活化能/ |
催化剂X |
33 |
91 |
| 催化剂Y |
43 |
72 |
|
①由上表判断,催化剂X________Y(填"优于或劣于"),理由是________.在反应进料气组成,压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如右图所示,升高温度时,下列关于积碳反应,消碳反应的平衡常数(K)和速率(v)的叙述正确的是________(填标号)
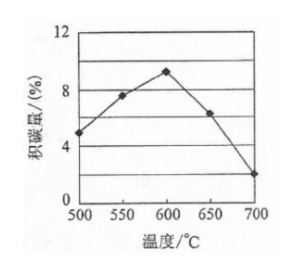
| A. | 、 均增加 |
| B. | 减小、 增加 |
| C. | 减小、 增加 |
| D. | 增加的倍数比 增加的倍数大 |
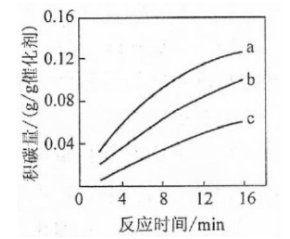
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为 (k为速率常数)。在 一定时,不同 下积碳量随时间的变化趋势如右图所示,则 、 、 从大到小的顺序为________
丙烯腈(CH 2=CHCN)是一种重要的化工原料,工业上可用"丙烯氨氧化法"生产.主要副产物有丙烯醛(CH 2=CHCHO)和乙腈(CH 3CN)等。回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C 3H 3N)和副产物丙烯醛(C 3H 4O)。热化学方程式如下:①C 3H 6(g)+NH 3(g)+ O 2(g)═C 3H 3N(g)+3H 2O(g)△H=﹣515kJ•mol ﹣ 1
②C 3H 6(g)+O 2(g)═C 3H 4O(g)+H 2O(g)△H=﹣353kJ•mol ﹣ 1
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________.
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃.低于460℃时,丙烯腈的产率________(填"是"或"不是")对应温度下的平衡转化率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号).

| A. |
催化剂活性降低 |
B. |
平衡常数变大 |
| C. |
副反应增多 |
D. |
反应活化能增大 |
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示.由图可知,最佳n(氨)/n(丙烯)约为________,理由是________.进料气氨、空气、丙烯的理论体积比约为________.
二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:
该反应一般认为通过如下步骤来实现:
①
②
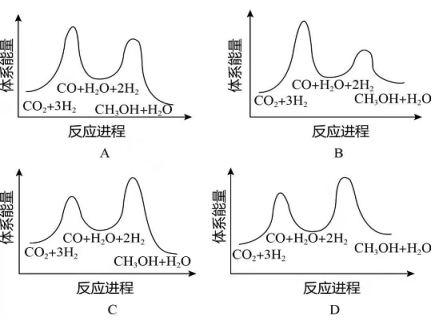
总反应的 _______ ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是________(填标号),判断的理由是_______。
(2)合成总反应在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在 ℃下的 、在 下的 如图所示。
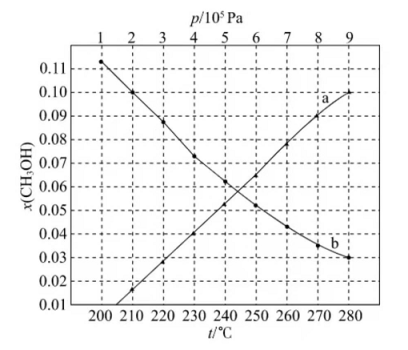
①用各物质的平衡分压表示总反应的平衡常数,表达式 ________;
②图中对应等压过程的曲线是________,判断的理由是_________;
③当 时, 的平衡转化率 __________,反应条件可能为________或_______。