有下列反应(其中A、B、C、D各代表一种元素)其中还原性强弱顺序为 ( )
① 2A-+B2 = 2B-+A2 ② 2A-+C2 = 2C-+A2
③ 2B-+C2 = 2C-+B2 ④ 2C-+D2 = 2D-+C2
A.A-> B-> C-> D- B.D->C->B-> A- C.D-> B-> A-> C- D.A-> C->D-> B-
已知某温度时发生如下反应:①C+CO2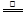 2CO;②C+H2O
2CO;②C+H2O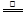 CO+H2③CO+H2O
CO+H2③CO+H2O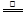 CO2+H2。由此可以判断,在该温度下,C、CO、H2的还原性强弱的顺序是( )
CO2+H2。由此可以判断,在该温度下,C、CO、H2的还原性强弱的顺序是( )
A.C>CO>H2 B.CO>C>H2 C.C>H2>CO D.CO>H2>C
根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是( )
I2+SO2+2H2O=H2SO4+2HI
2FeCl2+Cl2=2FeCl3
2FeCl3+2HI=2FeCl2+2HCl+I2
| A.I->Fe2+>Cl->SO2 | B.Cl->Fe2+>SO2>I- |
| C.Fe2+>I->Cl->SO2 | D.SO2>I->Fe2+>Cl- |
高锰酸钾是一种典型的强氧化剂。完成下列填空:
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+Cu2S+H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)
② MnO4-+CuS +H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是 (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量0.8 mol d.还原性的强弱:Mn2+>Cu2S
II:在稀硫酸中,KMnO4与 (NH4)2Fe(SO4)2也能发生氧化还原反应。
(2)写出KMnO4与(NH4)2Fe(SO4)2反应的离子方程式: 。
(3)欲配制480mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。需要的玻璃仪器有 .
III:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。请回答:
(4)用软锰矿制备K2MnO4的化学方程式是: 。
(5)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为 。并用单线桥表示电子的转移情况 。
向CuSO4溶液中逐滴加入 KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通人 SO2气体,溶液逐渐变成无色。下列分析正确的是( )
| A.滴加KI溶液时,转移2 mol e— 时生成 1 mol白色沉淀 |
| B.通入SO2后溶液逐渐变成无色,体现了 SO2的漂白性 |
| C.通入SO2时,SO2与I2反应,I2作还原剂 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2> SO2 |
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
| A.2Fe3++SO2+2H2O = 2Fe2++SO42-+4H+ |
| B.H2O2+H2SO4 = SO2↑+O2↑+2H2O |
| C.I2+SO2+2H2O = H2SO4+2HI |
| D.2Fe2++Cl2 = 2Fe3++2Cl- |
下列说法正确的是()
| A.阳离子只能得电子被还原,阴离子只能失电子被氧化 |
| B.已知①Fe+Cu2+=Fe2++Cu;②2Fe3++Cu=2Fe2++Cu2+,则氧化性强弱顺序为: Fe3+>Cu2+>Fe2+ |
| C.化学反应中,得电子越多的氧化剂,其氧化性就越强 |
| D.已知还原性:B->C->D-,反应2C-+D2=2D-+C2和反应2C-+B2=2B-+C2都能发生 |
下列实验对应的现象及结论均正确且两者具有因果关系的是
| 选项 |
实验 |
现象 |
结论 |
| A |
SO2通入BaCl2溶液,然后滴入稀硝酸 |
白色沉淀,白色沉淀不溶于稀硝酸 |
所得沉淀为BaSO3,后转化为BaSO4 |
| B |
浓硫酸滴入蔗糖中,并搅拌 |
得黑色蓬松的固体并有刺激性气味气体 |
该过程中浓硫酸仅体现吸水性和脱水性 |
| C |
向FeCl2溶液中加入足量Na2O2粉末 |
出现红褐色沉淀和无色气体 |
FeCl2溶液部分变质 |
| D |
向足量含淀粉的FeI2溶液中滴加2滴氯水 |
溶液变蓝 |
还原性:I->Fe2+ |
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝.
下列判断不正确的是
| A.化合物KCrO2中Cr元素为+3价 |
| B.实验①证明Cr2O3是两性氧化物 |
| C.实验②证明H2O2既有氧化性又有还原性 |
| D.实验③证明氧化性:Cr2O72->I2 |
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断正确的是
| A.化合物KCrO2中Cr元素为+3价 |
| B.实验①证明Cr2O3是酸性氧化物 |
| C.实验②证明H2O2既有氧化性又有还原性 |
| D.实验③证明氧化性:Cr2O72- > I2 |
已知:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O; Cl2+2FeCl2=2FeCl3; 2KI+2FeCl3=2KCl+I2+2FeCl2。 则下列判断正确的是
| A.氧化性MnO4->Cl2>I2>Fe3+ | B.还原性:Fe2+>I->Cl- |
| C.Fe3+能将I-氧化为I2 | D.Fe2+只有还原性 |
根据下列化学方程式,判断有关物质的还原性强弱顺序正确的是( )
①I2+SO2+2H2O=H2SO4+2HI;
②2FeCl2+Cl2=2FeCl3;
③2FeCl3+2HI=2FeCl2+2HCl+I2
| A.I->Fe2+>Cl->SO2 | B.Cl->Fe2+>SO2>I- |
| C.Fe2+>I->Cl->SO2 | D.SO2>I->Fe2+>Cl- |
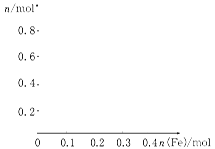
向含有0.8 mol的稀硝酸中慢慢加入22.4 g的铁粉,假设反应分为两个阶段。
第一阶段为:Fe+HNO3(稀)→Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段发生反应的离子方程式:
第一阶段: 。
第二阶段: 。
(2)在图中画出溶液中Fe2+、Fe3+、NO3-的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。
根据反应式:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是
| A.Br-、Fe2+、I- | B.I-、Fe2+、Br- | C.Br-、I-、Fe2+ | D.Fe2+、I-、Br- |