下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O
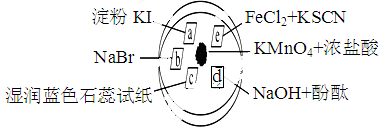
对实验现象的“解释或结论”正确的是( )
| 选项 |
实验现象 |
解释或结论 |
| A |
a处变蓝,b处变红棕色 |
氧化性:Cl2>Br2>I2 |
| B |
c处先变红,后褪色 |
氯气与水生成了酸性物质 |
| C |
d处立即褪色 |
氯气与水生成了漂白性物质 |
| D |
e处变红色 |
还原性:Fe2+>Cl- |
根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是( )
I2+SO2+2H2O=H2SO4+2HI
2FeCl2+Cl2=2FeCl3
2FeCl3+2HI=2FeCl2+2HCl+I2
| A.I->Fe2+>Cl->SO2 | B.Cl->Fe2+>SO2>I- |
| C.Fe2+>I->Cl->SO2 | D.SO2>I->Fe2+>Cl- |
金属铜能被氯化铁浓溶液腐蚀,其化学反应是:Cu+2FeCl3=CuCl2+2FeCl2。现将有铜的印刷线路板浸入120mL氯化铁浓溶液中,有9.6g铜被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶解的物质。(设溶液体积不变,且不考虑金属离子水解)。请回答下列问题:
(1)向溶液中加入铁粉后,发生反应的离子反应方程式为 , 。
(2)充分反应后,溶液中存在4.8g不溶物的成分为 。
(3)充分反应后溶液中一定不存在的金属离子为 。
(4)比较Fe2+、Fe3+、Cu2+的氧化性大小: 。
(5)试计算最后溶液中Fe2+离子的物质的量浓度 mol/L
常温下在下列溶液中发生如下反应:由此判断下列说法正确的是( )
①16H++10Z-+2XO4-==2X2++5Z2+8H2O ②2A2++B2===2A3++2B- ③2B-+Z2==B2+2Z-
| A.反应Z2+2A2+==2A3++2Z-不能进行 |
| B.Z元素在①③反应中均被氧化 |
| C.还原性由强到弱的顺序是A2+、B-、Z-、X2+ |
| D.氧化性由弱到强的顺序是XO4-、Z2、B2、A3+ |
比较是化学学习中的一种重要方法。下列各组比较中不正确的是
| A.在相同条件下的溶解度:NaHCO3>Na2CO3 |
| B.还原性:I->Br->Cl->F- |
| C.氧化性:F2> Cl2 > Br2>I2 |
| D.碳酸氢钠溶液与稀盐酸互滴时两种操作现象相同 |
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
| A.2Fe3++SO2+2H2O = 2Fe2++SO42-+4H+ |
| B.H2O2+H2SO4 = SO2↑+O2↑+2H2O |
| C.I2+SO2+2H2O = H2SO4+2HI |
| D.2Fe2++Cl2 = 2Fe3++2Cl- |
常温下,在溶液中可发生以下反应:①2Fe2++ Br2= 2Fe3+ + 2Br-,
②2Br-+ Cl2=Br2 + 2Cl-, ③2Fe3+ + 2I-= 2Fe2++ I2;由此判断下列说法错误的是
| A.铁元素在反应①中被氧化,在③中被还原 |
| B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 |
| C.氧化性强弱顺序为:Cl2 > I2 > Br2 > Fe3+ |
| D.还原性强弱顺序为:I- > Fe2+ > Br- > Cl- |
下列实验均发生了化学反应:①将铁钉放入CuSO4溶液中;②向FeSO4溶液中滴加浓HNO3;③将铜丝放入FeCl3溶液中。下列判断中,正确的是
| A.上述实验证明了氧化性:Fe3+>Fe2+>Cu2+ |
| B.上述实验证明了Fe2+既有氧化性又有还原性 |
| C.实验①、③中的化学反应都是置换反应 |
| D.向三个实验后的溶液中加入足量NaOH溶液,最终都有Fe(OH)3生成 |
分析下列反应:3S+6 KOH = 2K2S+K2SO3+3H2O,据此作答:
(1)用双线桥标出该反应中电子的转移方向和数目:3S +6 KOH = 2K2S+K2SO3+3H2O
(2)该反应的氧化产物是 。
(3)该反应的氧化剂与还原剂的质量比是 。
(4)当消耗0.3 mol S时,则转移的电子数是 。
下列实验对应的现象及结论均正确且两者具有因果关系的是
| 选项 |
实验 |
现象 |
结论 |
| A |
SO2通入BaCl2溶液,然后滴入稀硝酸 |
白色沉淀,白色沉淀不溶于稀硝酸 |
所得沉淀为BaSO3,后转化为BaSO4 |
| B |
浓硫酸滴入蔗糖中,并搅拌 |
得黑色蓬松的固体并有刺激性气味气体 |
该过程中浓硫酸仅体现吸水性和脱水性 |
| C |
向FeCl2溶液中加入足量Na2O2粉末 |
出现红褐色沉淀和无色气体 |
FeCl2溶液部分变质 |
| D |
向足量含淀粉的FeI2溶液中滴加2滴氯水 |
溶液变蓝 |
还原性:I->Fe2+ |
常温下溶液中可发生如下反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O ②2A2++B2=2A3++2B- ③2B-+Z2=B2+2Z-,由此判断下列说法错误的是( )
| A.反应Z2+2A2+=2A3++2Z-可以进行 |
| B.Z元素在①③反应中均被还原 |
| C.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ |
| D.还原性由强到弱顺序是A2+、B-、Z-、X2+ |
已知反应:①MnO2+4HCl PbCl2+Cl2↑+2H2O, ②Cu+2Fe3+=Cu2++2Fe2+, ③Cl2+2Fe2+=2Cl-+2Fe3+。则有关物质(离子)的氧化性由强到弱的顺序为
PbCl2+Cl2↑+2H2O, ②Cu+2Fe3+=Cu2++2Fe2+, ③Cl2+2Fe2+=2Cl-+2Fe3+。则有关物质(离子)的氧化性由强到弱的顺序为
| A.Cl2>Fe3+>Cu2+>MnO2 | B.MnO2>Cl2>Fe3+>Cu2+ |
| C.Fe3+>Cu2+>MnO2>Cl2 | D.Cu2+>Fe3+>Cl2>MnO2 |
已知氧化性顺序是:Cl2>Br2>Fe3+>I2,在FeI2和FeBr2混合溶液中,通入一定量Cl2,溶液中存在的离子组不合理的是( )
| A.Fe3+ Br— Cl— | B.Fe2+ Br— Cl— |
| C.Fe2+ Cl— I— | D.Fe2+ Br— Cl— I— |
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝.
下列判断不正确的是
| A.化合物KCrO2中Cr元素为+3价 |
| B.实验①证明Cr2O3是两性氧化物 |
| C.实验②证明H2O2既有氧化性又有还原性 |
| D.实验③证明氧化性:Cr2O72->I2 |