质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是( )
①正极反应为:O2+4H++4e- 2H2O
2H2O
②负极反应为:2H2-4e- 4H+
4H+
③总的化学反应为:2H2+O2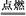 2H2O
2H2O
④氢离子通过电解质向正极移动
A.①②③ B.②③④ C.①②④ D.①②③④
氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,已用于宇宙飞船及潜艇中,其电极反应为:
负极:2H2+4OH--4e- 4H2O 正极:O2+2H2O+4e-
4H2O 正极:O2+2H2O+4e- 4OH-
4OH-
所产生的水还可作为饮用水,今欲得常温下1 L水,则电池内电子转移的物质的量约为( )
| A.8.9×10-3 mol |
| B.4.5×10-2 mol |
| C.1.1×102 mol |
| D.5.6×10 mol |
Zn MnO2干电池应用广泛,其电解质溶液是ZnCl2
MnO2干电池应用广泛,其电解质溶液是ZnCl2 NH4Cl混合溶液。
NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2 NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
下面是两种常见的化学电源示意图,有关说法不正确的是( )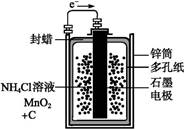
干电池示意图
铅蓄电池示意图
| A.上述电池分别属于一次电池、二次电池 |
| B.干电池在长时间使用后,锌筒被破坏 |
| C.铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 g |
| D.铅蓄电池负极材料为Pb |
普通锌锰干电池在放电时总反应方程式可以表示为:Zn(s)+2MnO2+2N Zn2++Mn2O3(s)+2NH3↑+H2O,在此电池放电时正极(碳棒)上发生反应的物质是( )
Zn2++Mn2O3(s)+2NH3↑+H2O,在此电池放电时正极(碳棒)上发生反应的物质是( )
| A.Zn | B.碳 | C.MnO2和N | D.Zn2+和NH3 |
水煤气不仅是合成氨的原料气也是合成烃及其化工产品的原料。
(1)在水煤气燃料电池中,通CO、H2的极为电池的 极(选填“正”、“负”)。
(2)水煤气变换反应:CO(g) + H2O(g)  CO2(g) + H2(g) △H<0,下列措施能提高反应速率的有 (不定项选择)。
CO2(g) + H2(g) △H<0,下列措施能提高反应速率的有 (不定项选择)。
a.升高温度 b.加入催化剂 c.增大压强 d.降低浓度
(3)H2和N2在催化剂、高温高压条件下合成氨的化学方程式为 。
(4)将标准状况下582.4L合成气[已知:n(CO)∶n(H2)= 4∶9]通入合成塔,一定条件下可发生2CO(g)+ 4H2(g) → CH2=CH2(g)+2H2O(g);CO(g)+3H2→CH4(g)+H2O(g),充分反应后,经测定产品中只有甲烷、乙烯和水蒸气(假定CO和H2均无剩余),逸出的气体中乙烯的物质的量为 。
美国圣路易斯大学研制了一种新型的乙醇电池,用质子(H+)溶剂,在200oC左右时供电。电池总反应为:C2H5OH +3O2=2CO2 +3H2O,电池示意如下图,下列说法正确的是
| A.a极为电池的正极 |
| B.电池工作时电子由b极沿导线经灯泡再到a极 |
| C.电池正极的电极反应为:4H+ + O2 + 4e=2H2O |
| D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiO(OH) + 2H2O Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2 + OH- -e- NiO(OH )+ H2O NiO(OH )+ H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为 +
+

 。下列说法一定正确的是
。下列说法一定正确的是
A.充电时,阴极的电极反应式为  |
B.电池放电时,负极的电极反应式为 |
| C.电池放电时,Cl-从负极室穿过选择性透过膜移向正极室 |
| D.放电时,电路中每流过0.3 mol电子,Fe3+的物质的量会减少0.1mol |
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题
(1)肼的结构式为 。
(2)肼燃料电池原理如图所示,左边电极上发生的电极反应式为_________________。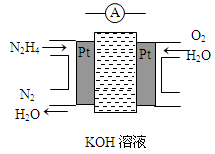
(3)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H=-67.7kJ·mol-1 ①
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ·mol-1 ②
2NO2(g)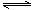 N2O4(g) △H=-52.7kJ·mol-1 ③
N2O4(g) △H=-52.7kJ·mol-1 ③
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:___ _
(4)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在催化剂作用下,用尿素
[CO(NH2)2]和次氯酸钠与氢氧化钠的混合溶液反应获得,尿素法反应的离子方程式为
____________________________________________________ 。
(5)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同且均为a L。
①B中可通过观察________________判断可逆反应2NO2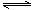 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
③若容器A中到达平衡所需时间为t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于____________________。
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为_____L。
下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是 ,电极名称是 ,N的电极反应式为 ,加入乙醇的铂电极的电极反应式为 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为 。
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为 。
(4)若M、N均为石墨电极,将乙池改为电解500mL含KNO3和Cu(NO3)2的混合液一段时间后,在两极上均生成11.2L(标准状况)气体。则M极产生的气体是 ,原混合液中Cu2+的物质的量浓度是 mol/L。
汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:
Pb (s)+ PbO2(s) +2H2SO4(aq) 2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是( )
2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是( )
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) |
| C.铅蓄电池属于一次电池 |
| D.电池放电时,溶液酸性增强 |
下列有关说法正确的是
| A.铅蓄电池在放电时,两极质量均增加 |
| B.钢铁在中性溶液中主要发生析氢腐蚀 |
| C.在室温下能自发进行的反应,其△H一定小于0 |
| D.0.1 mol·L-1Na2S溶液加水稀释时,n(Na+)/n(S2-)值将减小 |
已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是 ( )
| A.充电时作阳极,放电时作负极 | B.充电时作阳极,放电时作正极 |
| C.充电时作阴极,放电时作负极 | D.充电时作阴极,放电时作正极 |
Ⅰ.将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
(1)通甲烷的铂丝为原电池的_______极,发生的电极反应为_______________。
(2)该电池工作时(放电)反应的总化学方程式为___________________________________。
Ⅱ.铅蓄电池是化学电源,它工作时的电池反应为:PbO2+Pb+2H2SO4===2PbSO4+2H2O;
试回答:
(3)铅蓄电池正极的电极材料是_____________。
(4)工作时该铅蓄电池负极的电极反应是_____________________。
(5)铅蓄电池工作时,电解质溶液的密度_______(填“减小”“增大”或“不变”,下同),pH_______。
(6)如果用铅蓄电池做电源电解饱和食盐水制取Cl2,当制得0.05molCl2时,在理论上电池内部消耗的H2SO4的物质的量是______________。