(共8分)新型高能钠硫电池以熔融的钠、硫为电极,以导电的陶瓷为固体电解质。该电池放电时为原电池,充电时为电解池,反应原理为:2Na+xS Na2Sx。
Na2Sx。
(1)放电时Na发生________反应(填:氧化或还原),S作________极
(2)充电时Na所在电极与直流电源的________极相连。
(3)放电时负极反应为_______________________;
(4)用此电池作电源电解饱和NaCl溶液,当阳极产生33.6 L(标准状况)气体时,消耗金属Na的质量为______。
下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点。试回答下列问题:
(1)图中通过负载(负载是指用电器)的电子流动方向 (填“向左”或“向右”),负极发生 反应。
(2)写出氢氧燃料电池工作时的电极反应式负极: ,正极: ,
(3)电池工作时,负极区的PH值 (填“增大”或“不变”或“减小”)。
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用一个月才充电一次。假定放电过程中,甲醇完全氧化产生二氧化碳被充分吸收生成CO32-。
(1)该电池反应的离子方程式为__________________________。
(2)甲醇在__________极发生反应(填“正”或“负”),电池中放电过程中溶液pH将_________(填“下降”、“上升”或“不变”);若有16克甲醇蒸气被完全氧化产生电能,并利用该过程中释放的电能电解足量的硫酸铜溶液,假设能量利用率为80%,则将产生标准状况下氧气__________L。
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷代表汽油。该电池的正极反应式为_____________________。
(4)放电时固体电解质里的O2-离子的移动方向是向________极移动(填“正”或“负”)。
在银锌原电池中,以硫酸铜为电解质溶液,锌为 极,电极上发生的是________反应(“氧化”或“还原”), 银为__ ___极,电极反应式是___ _ _____,银表面上可观察到的现象是_ _______;原电池反应的离子方程式为_________。
下图是一个化学过程的示意图。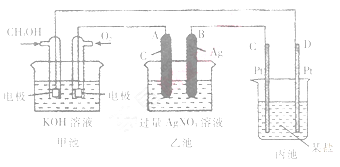
(1)请回答图中甲池是______装置,其中OH-移向________极(填“CH3OH”或“O2”)
(2)写出通入CH3OH的电极的电极反应式_________。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为_________极(填“A”或“B”),并写出此电极反应的电极反应式____________。
(4)乙池中反应的离子方程式为____________。
(5)当乙池中B(Ag)极的质量增加5.40g时,乙池的pH是________(若此时乙池中溶液的体积为500mL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是_______(填序号).
| A.MgSO4 | B.CuSO4 | C.NaCl | D.AgNO3 |
钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应为:
Zn + 2OH--2e- =" ZnO" + H2O Ag2O + H2O + 2e- =" 2Ag" + 2OH-
电池的负极是 (填电极材料),正极发生的是 反应(填反应类型),
总反应式为 。
氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定,请回答: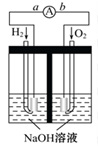
(1)氢氧燃料电池的能量转化形式主要是______,在导线中电子流动方向为______(用a、b表示)。
(2)负极反应式为__________________。
Ⅰ.将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
(1)通甲烷的铂丝为原电池的_______极,发生的电极反应为_______________。
(2)该电池工作时(放电)反应的总化学方程式为___________________________________。
Ⅱ.铅蓄电池是化学电源,它工作时的电池反应为:PbO2+Pb+2H2SO4===2PbSO4+2H2O;
试回答:
(3)铅蓄电池正极的电极材料是_____________。
(4)工作时该铅蓄电池负极的电极反应是_____________________。
(5)铅蓄电池工作时,电解质溶液的密度_______(填“减小”“增大”或“不变”,下同),pH_______。
(6)如果用铅蓄电池做电源电解饱和食盐水制取Cl2,当制得0.05molCl2时,在理论上电池内部消耗的H2SO4的物质的量是______________。
(9分)如下图装置实验,A、B两烧杯分别盛放200 g10%NaOH和足量CuSO4溶液。通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5 g(不考虑水的蒸发)。
请回答下列问题:
(1)电源P极为 极;请分别写出b极和c极上发生的电极反应 式: ;
(2)c极上析出固体铜的质量为 g
(3)若装置中用铅蓄电池作电源,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
假设在a极制得气体0.050 mol,这时电池内消耗的H2SO4的物质的量至少是 mol
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4  2PbSO4+2H2O,现以铅蓄电池作电源,用惰性电极电解100 mL 4 mol·/L Cu(NO3)2溶液,一定时间后在阳极收集到标准状况下气体1.12 L。
2PbSO4+2H2O,现以铅蓄电池作电源,用惰性电极电解100 mL 4 mol·/L Cu(NO3)2溶液,一定时间后在阳极收集到标准状况下气体1.12 L。
(1)铅蓄电池中消耗的硫酸为 mol;
(2)停止电解,向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe2+的物质的量浓度为 mol/L(设溶液的体积不变)。
(14分)分析下图,回答以下问题:
(1)水电解生成H2,首先要解决的问题是________________________________。
(2)氢气作为理想的“绿色能源”除了来源丰富,还有哪些优点:
①________________________________,②_____________________________。
(3)氢氧燃料电池是氢能源利用的一个重要方向,氢气在________极上发生________反应。若电解质溶液为KOH溶液,写出正负极上的电极反应:
正极________________________________,负极________________________________。
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。
(1)工业上正在研究利用CO2来生产甲醇燃料的方法。
已知:H2(g)+1/2O2(g)===H2O(g)ΔH1=-242 kJ/mol
CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(g) ΔH2=-676 kJ/mol
①写出CO2和H2反应生成气态甲醇等产物的热化学方程式:___________________。
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是________(填字母序号)。
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:
①该电池外电路电子的流动方向为________(填写“从A到B”或“从B到A”)。
②工作结束后,B电极室溶液的酸性与工作前相比将________(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。
③A电极附近甲醇发生的电极反应式为________。
水煤气不仅是合成氨的原料气也是合成烃及其化工产品的原料。
(1)在水煤气燃料电池中,通CO、H2的极为电池的 极(选填“正”、“负”)。
(2)水煤气变换反应:CO(g) + H2O(g)  CO2(g) + H2(g) △H<0,下列措施能提高反应速率的有 (不定项选择)。
CO2(g) + H2(g) △H<0,下列措施能提高反应速率的有 (不定项选择)。
a.升高温度 b.加入催化剂 c.增大压强 d.降低浓度
(3)H2和N2在催化剂、高温高压条件下合成氨的化学方程式为 。
(4)将标准状况下582.4L合成气[已知:n(CO)∶n(H2)= 4∶9]通入合成塔,一定条件下可发生2CO(g)+ 4H2(g) → CH2=CH2(g)+2H2O(g);CO(g)+3H2→CH4(g)+H2O(g),充分反应后,经测定产品中只有甲烷、乙烯和水蒸气(假定CO和H2均无剩余),逸出的气体中乙烯的物质的量为 。
根据题意完成下列方程式
(1)写出实验室制备氨气的化学方程式 ;
(2)写出实验室制备Cl2的离子方程式 ;
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;K2FeO4-Zn可组成碱电池,电池总反应式为:2Fe O42-+8H2O+3Zn=2Fe(OH)3+3Zn(OH)2+4OH-。写出该电池的正极反应式 ;