(I)下列装置能组成原电池的是 (填序号)
(II)将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)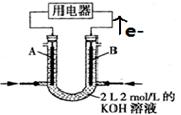
① (填A或B)处电极入口通甲烷,其电极反应式为 ;
②当消耗甲烷的体积为11.2 L(标准状况下)时,则导线中转移电子数为 ,消耗KOH的物质的量为 。
(I)下列装置能组成原电池的是 (填序号)
(II)将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)
① (填A或B)处电极入口通甲烷,其电极反应式为 ;
②当消耗甲烷的体积为11.2 L(标准状况下)时,则导线中转移电子数为 ,消耗KOH的物质的量为 。