氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定,请回答: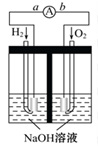
(1)氢氧燃料电池的能量转化形式主要是______,在导线中电子流动方向为______(用a、b表示)。
(2)负极反应式为__________________。
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下列相关说法正确的是________(填序号)。
A.通过某种电池单位质量或单位体积所能输出能量的多少,可以判断该电池的优劣
B.二次电池又称充电电池或蓄电池,这类电池可无限次重复使用
C.除氢气外,甲醇、汽油、氧气等都可用作燃料电池的燃料
D.近年来,废电池必须进行集中处理的问题被提上日程,其首要原因是电池外壳的金属材料需要回收
(2)目前常用的镍(Ni)镉(Cd)电池,其电池总反应式可表示为2Ni(OH)2+Cd(OH)2 Cd+2NiO(OH)+2H2O
Cd+2NiO(OH)+2H2O
已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是________(填序号)。
A.以上反应是可逆反应
B.反应环境为碱性
C.电池放电时Cd作负极
D.该电池是一种二次电池
(3)在宇宙飞船和其他航天器上经常使用的氢氧燃料电池是一种新型电源,其构造如图所示:a、b两个电极均由多孔的碳块组成,通入的氢气和氧气由孔隙中逸入,并在电极表面发生反应而放电。
①a电极是电源的________极;
②若该电池为飞行员提供了360 kg的水,则电路中通过了________mol电子。
已知化学能与其他形式的能可以相互转化。填写下表的空白:
| 化学反应方程式(例子) |
能量转化形式 |
| ① |
由化学能转化为热能 |
②Pb+PbO2+2H2SO4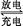 2PbSO4+2H2O 2PbSO4+2H2O |
|
③CaCO3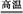 CaO+CO2↑ CaO+CO2↑ |
|
上述反应中属于氧化还原反应的是(填序号) 。
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答 下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答 下列问题。
(1)A是铅蓄电池的 极,铅蓄电池正极反应式为 ,放电过程中电解液的密度 (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是 ,该电极的电极产物共 g。
(3)Cu电极的电极反应式是 ,CuSO4溶液的浓度 (填“减小”、“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示 。
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
(1)可以将氧化还原反应2H2+O2=2H2O设计成原电池,若KOH溶液作电解质溶液,则正极反应式为 。若把H2改为甲烷,KOH溶液作电解质溶液,则负极反应式为 。
(2)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH。该电池的正极反应式为 ,负极反应式为 ,电池反应的离子方程式为: 。
(9分) 观察下列几个装置示意图,有关叙述正确的是
(1)在①图中,发生反应的化学方程式为: 。
(2)在②图中,待镀铁制品应与电源 极相连,电极反应式为: 。
(3)在③图中,外电路电子由 极流向 极,若电解液为KOH溶液,则b极的反应式为 。
(每空2分,共8分)熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:
2C4H10+26CO32--52e-=34CO2+10H2O
试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是 ,它来自 。
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
 (1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(用a、b 表示)。 (2)负极反应式为 。
(2)负极反应式为 。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________________________;
(3)在容积为2 L的密闭容器中,由CO2和H2合成甲醇(CO2+3H2  CH3OH + H2O)
CH3OH + H2O)
在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)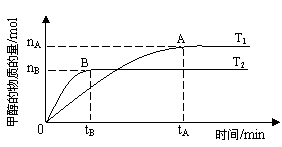
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH) =nA/tA mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)/n(CH3OH)增大
(4)在T1温度时,将1mol CO2和3mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为_________________________。
I.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题:
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以v (CO2)表示的反应速率为 (保留两位小数,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
(2)已知在常温常压下:
① 2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g)= H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池某电极的工作原理如下图所示:

该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是 L,将电解后的溶液加水稀释至1L,此时溶液的pH= 。
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具体有重要意义。
(1)如图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。

已知:

请写出NO与CO反应生成无污染气体的热化学方
程式: 。
(2)将0.20 mol N02和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。

①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到乎衡
b.当向容器中再充人0. 20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,N02的转化率减小
d.向该容器内充人He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)= mol·L-1·min-1
③第4 min时改变的反应条件为 (填“升温’’、“降温’’)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充人CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极反应式为 ,当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 mol。

(1)今有2H2+O2  2H2O反应,构成燃料电池,则负极通入的应是 ,正极通的应是 。电极反应式为正极: ;负极: ;
2H2O反应,构成燃料电池,则负极通入的应是 ,正极通的应是 。电极反应式为正极: ;负极: ;
(2)若把KOH溶液改为稀H2SO4作电解质,则电极反应式为
正极: ;负极: ;
(1)和(2)的电解质不同,反应后,其溶液的pH各有什么变化? ;
(3)若把H2改为CH4,用KOH溶液作电解质溶液,则负极的电极反应式为 。
(共10分前2个空每空一个1分,其余每空2分)依据氧化还原反应2Ag+(aq)+Cu(s) ="===" Cu2+(aq)+2Ag(s)设计的原电池如图所示:
请回答下列问题:
(1)外电路中的电子是从_______ 电极流向________电极。
(2)银电极发生的电极反应为________________________;
X电极上发生的电极反应为___________________________;
(3)LiSOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2==="4LiCl" +S +SO2↑。请回答下列问题:
写出电池的负极发生的电极反应为_________________________________________;
电池正极发生的电极反应为______________________________________;
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4 ( g ) + H2O ( g )=CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g )=CH3OH ( g ) △H=—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:
①写出阳极电极反应式 。
②写出除去甲醇的离子方程式 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的电极负极反应式,负极: 。
I.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题:
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以v (CO2)表示的反应速率为 (保留两位小数,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
(2)已知在常温常压下:
① 2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g)= H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池某电极的工作原理如下图所示:

该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是 L,将电解后的溶液加水稀释至1L,此时溶液的pH= 。