生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化率高,是一种真正意义上的绿色电池,其工作原理如图所示。已知C1极的电极反应方程式为:C2H5OH+3H2O-12e-=2CO2+12H+。下列说法不正确的是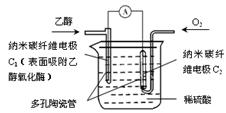
A.C1极为电池正极,C2极为电池负极
B.C2极的电极反应式为O2+4H++4e-=2H2O
C.该生物燃料电池的总反应方程式为
C2H5OH+3O2=2CO2+3H2O
D.电子由C2极经外电路导线流向C1极
下图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。下列说法中正确的是
| A.阳极的电极反应式为:2Cl-→Cl2↑+2e- |
| B.阴极的电极反应式为:TiO2 + 4e-→Ti + 2O2- |
| C.通电后,O2-、Cl-均向阴极移动 |
| D.石墨电极的质量不发生变化 |
氢氧燃料电池是一种新能源。下图为氢氧燃料电池示意图。下列说法不正确的是
| A.该装置能将化学能转化为电能 |
| B.A极是正极,B极是负极 |
| C.电子由A极通过导线流向B极 |
| D.产物为无污染的水,属于环境友好电池。 |
已知离子可在琼脂中移动。某简易电池如图所示。放电时,下列说法错误的是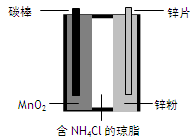
| A.锌极上电极反应式为:Zn-2e-= Zn2+ |
| B.MnO2得电子被还原 |
| C.NH4+ 离子通过琼脂向锌极移动 |
| D.外电路电流的方向从碳棒到锌片 |
Li-Al/FeS电池是一种正在开发的电动车用电池,该电池反应式为:
2Al+6Li++3FeS=2Al3++3Li2S+3Fe。有关该电池的下列说法中,正确的是
| A.作为二次电源,该电池在使用的过程中至少存在3种形式的能量转化 |
| B.Li-Al在电池中作为负极材料,负极的电极反应式为Li-e-=Li+ |
| C.该电池替代现在电动车广泛使用的铅蓄电池可以减少重金属的污染 |
| D.充电时,阴极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS |
氢氧燃料电池已用于航天飞机,它是以铂作电极,KOH溶液作电解质,下列叙述不正确的是( )
| A.H2在负极发生氧化反应 |
| B.燃料电池的能量转化率可达100% |
| C.产物为无污染的水,属于环境友好电池 |
| D.供电时的总反应为:2H2 + O2 = 2H2O |
某同学使用直流电源,在烧杯里电解饱和食盐水,电极用铁钉和碳棒。该同学错误地将铁钉接在电源正极,碳棒接负极.此情况下接通电源,观察到的现象可能是
| A.阳极和阴极上都产生了气泡 |
| B.阳极处产生了气泡,此气泡使湿润的碘化钾淀粉试纸变蓝 |
| C.溶液出现了灰绿色浑浊,后逐渐变成了红褐色 |
| D.阴极处未产生气泡,滴入酚酞试剂后变红 |
银锌(Ag—Zn)可充电电池广泛用做各种电子仪器的电源,电解质为KOH。其电池总反应式为Ag2O + Zn + H2O  2Ag + Zn(OH)2,下列说法正确的是
2Ag + Zn(OH)2,下列说法正确的是
| A.放电时Zn参与反应的电极为正极 |
| B.放电时负极附近的pH逐渐增大 |
| C.充电时阴极的电极反应为:Zn(OH)2 -2e-= Zn + 2OH- |
| D.充电时每生成1 mol Ag2O转移2 mol电子 |
关于铅蓄电池的说法正确的是
| A.在充电时,电池中c(H+)不断变小 |
| B.在充电时,蓄电池标有“—”的电极每通过2mol电子,将生成1mol PbO2 |
| C.在放电时,该电池的负极材料是铅板 |
| D.在放电时,正极发生的反应是:Pb(s) + SO42—(aq)= PbSO4(s) + 2e— |
已知铅蓄电池放电时发生如下反应:负极:Pb+SO42— -2e— =PbSO4,
正极:PbO2 + 4H+ + SO42— + 2e— = PbSO4 + 2H2O。实验室用铅蓄电池作电源,用惰性电极电解CuSO4溶液,当阴极析出2.4g铜时,铅蓄电池内消耗H2SO4物质的量至少是
| A.0.050mol | B.0.075mol |
| C.0.20mol | D.0.40mol |
已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是( )
| A.充电时作阳极,放电时作负极 | B.充电时作阳极,放电时作正极 |
| C.充电时作阴极,放电时作负极 | D.充电时作阴极,放电时作正极 |
锰锌干电池在放电时总反应方程式可以表示为:Zn(s)+2MnO2+2NH4+=Zn2++Mn2O3(s)+2NH3+H2O,在此电池放电时正极(碳棒)上发生反应的物质是( )
| A.Zn | B.碳 | C.MnO2和NH4+ | D.Zn和NH3 |
离子可在琼脂中移动,某简易电池如图所示,放电时,下列说法错误的是
| A.锌极上电极反应式为:Zn-2e-=Zn2+ |
| B.MnO2得电子被还原 |
| C.NH4+离子通过琼脂向锌极移动 |
| D.外线路中电流的方向从碳棒到锌片 |
高铁电池是一种新型可充电电池,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 下列判断正确的是
下列判断正确的是
| A.充电时阳极反应为:2FeO42-+8H2O-6e-=2Fe(OH)3+10OH- |
| B.充电时阴极附近溶液的pH变大 |
| C.放电时,负极材料为Zn |
| D.放电时,每转移0.2 mol电子,正极的质量减少6.5 g |