铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是( )
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是( )
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O |
| D.正极上发生的反应是:O2+4e-+2H2O=4OH- |
下列关于右图装置的说法正确的是
| A.银电极是负极 |
| B.铜电极上发生的反应为Cu-2e-=Cu2+ |
| C.外电路中的电子是从银电极流向铜电极。 |
| D.该装置能将电能转化为化学能 |
干电池的负极反应是:Zn –2e = Zn 2+,现以干电池作电源电解32.4g 34%的硝酸钾溶液,一段时间后,测得溶液中溶质的质量分数为36%,则干电池中消耗锌的物质的量为
| A.0.3mol | B.0.05mol | C.0.2mol | D.0.1mol |
获得“863”计划支持的环境友好型铝碘电池已研制成功,电解质溶液为AlI3溶液,电池总反应式为2Al+3I2=2AlI3。下列说法不正确的是
| A.该电池负极的电极反应为:Al–3e-=Al3+ |
| B.电池工作时,溶液中铝离子向正极移动 |
| C.消耗相同质量金属时,用锂作负极产生电子的物质的量比用铝时多 |
| D.当导线中有3.612×1024个电子通过时,电池负极质量减少27 g |
有关下图装置中的叙述正确的是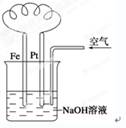
| A.这是电解NaOH溶液的装置 |
| B.溶液中发生了变化:4Fe(OH)2+O2+2H2O===4Fe(OH)3 |
| C.Fe为正极,电极反应为:Fe-2e-+2OH-=Fe(OH)2 |
| D.NaOH溶液的碱性逐渐减弱 |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为: 2CH3OH + 3O2 + 4OH-  2CO32- + 6H2O,则下列说法正确的是
2CO32- + 6H2O,则下列说法正确的是
| A.构成该电 池的正极和负极必须是两种活性不同的金属 |
| B.充电时有CH3OH生成的电极为阳极 |
| C.放电时电解质溶液的pH逐渐增大 |
| D.放电时负极的电极反应为:CH3OH-6e-+8OH-= CO32- + 6H2O |
下列关于铜锌原电池(稀硫酸作电解质溶液)的叙述错误的是
| A.电子由正极通过导线流向负极 | B.负极反应式为:Zn-2e-=Zn2+ |
| C.正极产生1molH2电池转移2mol电子 | D.可以用碳棒代替铜片作为正极 |
据报道,氢氧燃料电池公交汽车已经驶上北京街头,下列说法中,正确的是
| A.电解水制取氢气是理想而经济的制氢方法 |
| B.发展氢氧燃料电池汽车不需要安全高效的储氢技术 |
| C.氢氧燃料电池汽车的使用可以有效减少城市空气污染 |
| D.氢氧燃料电池是把氢气和氧气内部的热能转化为电能 |
上海自主研发了一种氢燃料汽车。它是以30%KOH溶液为电解质的氢氧燃料电池,下列有关说法中,不正确的是
| A.正极反应:O2 + 2H2O + 4e- ="==" 4OH- |
| B.发生氧化反应的是负极 |
| C.当正极消耗22.4 L H2时,负极11.2 L O2消耗(相同条件) |
| D.氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧 化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)下列说法错误的是 ( )
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH- (aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
一种由甲醇和氧气以及强碱作为电解质溶液的新型手机电池,其电池反应为:
2CH3OH + 3O2 + 4OH- 2 CO32— + 6H2O,则下列说法错误的是
2 CO32— + 6H2O,则下列说法错误的是
| A.充电时电解质溶液的pH逐渐增大 |
| B.放电时CH3OH参与反应的电极为正极 |
| C.充电时每生成1 mol CH3OH转移6 mol电子 |
| D.放电时负极的电极反应为:CH3OH-6e- +8OH- =CO32—+ 6H2O |
用铂作电极电解1L含有0.4molCuSO4和0.2molNaCl的水溶液,一段时间后在一个电极上得到了19.2 g Cu,在另一极上析出的气体在标况下的体积是
| A.4.48 L | B.5.6 L | C.6.72 L | D.13.44 L |
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为:
Zn + 2 MnO2 + H2O ="=" ZnO + 2MnO (OH)。下列说法正确的是
| A.该电池的正极为锌 |
| B.该电池反应中二氧化锰起催化剂作用 |
| C.当 0.l mol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023 |
| D.电池正极反应式为: 2MnO2 + 2e -+2H2O ="=2MnO" (OH)+2OH- |