镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)n |
Ksp |
|
|
| pH |
|
|
|
| 开始沉淀 |
沉淀完全 |
|
|
| Al(OH)3 |
1.9×10-23 |
3.4 |
4.2 |
| Fe(OH)3 |
3.8×10-38 |
2.5 |
2.9 |
| Ni(OH)2 |
1.6×10-14 |
7.6 |
9.8 |
回答下列问题:
(1) 用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ______ ____(填化学式)。
____(填化学式)。
(2) 写出加入Na2C2O4溶液的反应的化学方程式: 。
(3) 检验电解滤液时阳极产生的气体的方法: 。
(4) 写出“氧化”反应的离子方程式: 。
(5) 如何检验Ni(OH)3已洗 涤干净? 。
涤干净? 。
某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是 ( )
| A.正极反应式为:O2+2H2O+4e- |
| B.工作一段时间后,电解液中的KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2 |
| D.放电过程中,溶液中K+向负极移动 |
I。锂——空气电池能够提供相当于普通锂离子电池10倍的能量,因此它是很有前途的电池技术。下图是锂——空气电池放电时的工作示意图。
(1)图1中电极a是 极。
(2)电池中间的固体电解质(含阳离子交换膜)还能阻止H2O、N2、O2等物质的通过防止Li和这些物质反应。Li和水在常温下发生反应的化学方程式为 。
II.某些锂电池广泛应用于手机、数码相机及便携式电脑中。此种锂电池的负极通常由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成。总反应为:4Li+2SOCl2=4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生。以下说法中正确的是 。
| A.放电时电池内部Li+向负极移动[ |
| B.放电过程中,电池负极发生氧化反应 |
| C.放电时每移动2mol电子,有1molS被还原 |
D.放电时电池正极反应为 :3SOCl2+4e-=SO2+S+4Cl- :3SOCl2+4e-=SO2+S+4Cl- |
III.锂电池回收具有重要意义,重点回收的正极材料,其主要成分为钴酸锂(LiCoO2)、铝箔等。
某回收工艺流程如下:
(1)废旧电池残留有单质锂,拆解时需隔绝空气,是因为锂易与空气中的  反应。
反应。
(2)酸浸时钴酸锂发生反应的化学方程式为 。若用盐酸代替H2SO4、H2O2混合液也能达到酸浸目的,但不利之处是 。
(3)Li2CO3在水中的溶解度随温度升高而减小,操作2的步骤是:加热浓缩析出晶体、 、洗涤、干燥。
熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e- →34CO2+10H2O。试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
关于化学电源的叙述,错误的是
A.化学电源均是根据原电池的工作原理设计的
B. 在干电池中,碳棒只起导电作用,并不参加化学反应
C. 镍镉电池不能随意丢弃的原因是镍、镉的资源有限,价格昂贵
D. 燃料电池是一种高效、环保的新型化学电源
氢氧燃料电池是符合绿色化学理念的新型发电装置,下图为电池示意图,下列有关氢氧燃料电池的说法正确的是:
| A.该电池工作时电能转化成化学能 | |
B.该电池中a是正极 |
C.外电路中的电子由电极b通过导线流向a |
| D.该电池的总反应为:2H2+O2==2H2O |
我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均可视为零价),电池反应通常表示为LaNi5H6+6NiO(OH)==LaNi5+6Ni(OH)2。下列说法正确的是
| A.放电时储氢合金作正极 |
| B.放电时负极反应为:LaNi5H6-6e-=LaNi5+6H+ |
| C.充电时阳极周围C(OH-)减小 |
| D.充电时储氢合金作负极 |
生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池,其工作原理如图所示。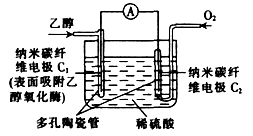
已知C1极的电极反应式为: C2H5OH+3H2O-12e-===2CO2+12H+。下列有关说法不正确的是
A.C1极为电池负极,C2极为电池正极
B.电子由C2极经外电路导线流向C1极
C.C2极的电极反应式为O2+4H+ +4e-===2H2O
D.该生物燃料电池的总反应为:C2H5OH+3O2===2CO2+3H2O
将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,可构成甲烷燃料电池,已知通入甲烷的一极,其电极反应式为:CH4+10OH-8e- = CO32—+7H2O;通入氧气的一极,其电极反应式为:2O2+4H2O+8e- = 8OH—,下列叙述正确的是
| A.通入甲烷的电极为正极 |
| B.在燃料电池工作时,溶液中的阴离子向正极移动 |
| C.正极发生氧化反应 |
| D.该燃料电池总反应为:CH4+2O2+2OH—= CO32—+3H2O |
氢镍电池是近年开发出来的可充电电池,可以取代会产生隔污染的镉镍电池。氢镍电池的总反应式 H2+NiO(OH)
H2+NiO(OH) Ni(OH)2,根据此反应式判断,下列叙述中正确的是
Ni(OH)2,根据此反应式判断,下列叙述中正确的是
| A.电池放电时,电池负极周围溶液pH不断增大 | B.电池放电时,镍元素被氧化 |
| C.电池充电时,氢元素被氧化 | D.电池放电时,H2是负极 |
某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是
| A.放电时,LiMn2O4发生氧化反应 |
| B.放电时,负极反应式为Li++LiMn2O4+e-=Li2Mn2O4 |
| C.该电池不能用水溶液作为电解质 |
D.放电过程中Li 向负极移动 向负极移动 |
下图是甲醇/过氧化氢燃料电池内部结构示意图。工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能。下列说法正确的是
| A.该电池的正极反应式:H2O2+2H++2e-=2H2O |
| B.燃料腔中的多孔石墨电极为该燃料电池的正极 |
| C.电池工作时,1mol甲醇被还原有6mol电子转移 |
| D.电路中的电子经正极、负极、质子交换膜后再回到正极,形成闭合回路 |
第三代混合动力车,可以用电动机、内燃机或二者结合作为动力。汽车在刹车或下坡时,
电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。下图是镍氢电池充放电原理的示意,其总反应式为: ,下列说法中正确的是
,下列说法中正确的是
| A.混合动力车上坡或加速时,溶液中的OH-向乙电极移动 |
| B.混合动力车刹车或下坡时,乙电极周围溶液的pH增大 |
| C.混合动力车上坡或加速时,乙电极电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH- |
| D.混合动力车刹车或下坡时,甲电极电极反应式为H2+2OH-+2e- =2H2O |
实验室用铅蓄电池作电源电解水,已知铅蓄电池放电时的电极反应如下:
负极:Pb + SO42――2e―="=" PbSO4
正极:PbO2 + 4H+ + SO42―+2e― ="=" PbSO4+ 2H2O
若制得0.1mol 的H2,此时电池内消耗的硫酸的物质的量至少是
| A.0.025 mol | B.0.50 mol | C.0.10 mol | D.0.20 mol |
下图是氨氧燃料电池示意图,按照此图的提示,回答下列问题: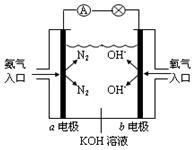
(1)a电极作______极(填“正”、“负”或“阴”、“阳”),其电极反应式为_________________;
(2)反应一段时间后,电解质溶液的PH将 (填“增大”、“减小”或“不变”);
(3)已知N2(g)+3H2(g)=2NH3(g) ΔH=" —92.4" kJ·mol-1;2H2(g)+O2(g)=2H2O(g) ΔH=" —483.6" kJ·mol-1,试写出氨气完全 燃烧生成气态水的热化学方程式:__________________________;
燃烧生成气态水的热化学方程式:__________________________;
(4)若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上97.5g锌,理论上至少需要消耗氨气_________L(标准状况)。