银锌蓄电池是一种高能电池,它的两极材料分别为锌和氧化银,电解质溶液为KOH溶液,该电池反应的化学方程式为:Zn+Ag2O+H2O Zn(OH)2+2Ag,下列判断正确的是
Zn(OH)2+2Ag,下列判断正确的是
| A.电池放电时,正极区溶液pH减小 |
| B.电池放电完后,需补充注入水 |
| C.负极电极反应式:2Ag+2OH--2e-=Ag2O+H2O |
| D.正极电极反应式:Ag2O+H2O+2e-=2Ag+2OH- |
(5分)我国经济发展对能源的需求与日俱增。一种新型燃料电池是将两根特制电极插入氢氧化钾溶液中,然后从两极分别通入甲烷和氧气,其电极反应式为:
X极:CH4+10OH- -8e- ="=" CO32-+7H2O Y极:4H2O+2O2+8e- ==8OH-
( 1)、指出该电池的正极__________(X极或Y极)(1 分)
分)
(2)、在标准状况下,通入5.6L甲烷气体,完全反应后有__________mol电子转移;
(3)、该电池的电解质溶液的PH变化是__________(填升高、降低、不变)(2分)
氯碱工业的一种节能新工艺,将电解池与燃料电池相组合,相关物料的传输与转化关系如下图所示(电极未标出):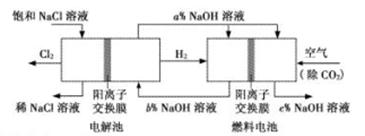
下列说 法正确的是
法正确的是
| A.电解池的阴极反应式为2H2O+2e-=H2↑+2OH- |
| B.通入空气的电极为负极 |
| C.电解池中产生2mol Cl2,理论上燃料电池中消耗0.5 mol O2 |
| D.a、b、c的大小关系为:a>b=c |
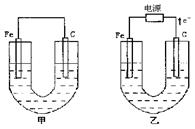
下列关于右图所示装置的说法中,正确的是
| A.若M是电流计,则该装置可以将电能转化为化学能 |
| B.若M是直流电源,一段时间后铜棒上可以镀上铂 |
| C.若M是直流电源,当有1.12L(标准状况)气体生成时,电路中转移了0.2mole- |
| D.M无论是电流计还是直流电源,该装置中都有反应Ag+ + e- =" Ag" 发生 |
甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ,则甲醇燃烧的热化学方程式为 。
(2)甲醇燃料电池的结构示意图如下左图。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
(3)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H =-49.0KJ/mol
CH3OH(g)+H2O(g)△H =-49.0KJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如上右图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②该反应的平衡常数表达式为 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
甲、乙两池电极材料如图所示,请按要求回答下列问题:
|
据报道,最近摩托罗拉公司研制了一种有甲醇和氧气,以及强碱作电解质的新型手机电池,电量可达到现用镍氢电池的10倍,有关此电池的叙述错误的是
| A.溶液中的阳离子移向正极 | |
| B.负极反应式:CH3OH + 8OH-- 6e-= CO32- + 6H2O | |
C.电池在使用过程中,电解质溶液的c(OH-)不变 |
D.当外电路通过6 mol电子时,理论上消耗1.5 mol O2 |
生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化率高,是一种真正意义上的绿色电池,其工作原理如图所示。已知C1极的电极反应方程式为:C2H5OH+3H2O-12e-=2CO2+12H+。下列说法不正确的是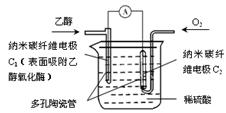
A.C1极为电池正极,C2极为电池负极
B.C2极的电极反应式为O2+4H++4e-=2H2O
C.该生物燃料电池的总反应方程式为
C2H5OH+3O2=2CO2+3H2O
D.电子由C2极经外电路导线流向C1极
下图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。下列说法中正确的是
| A.阳极的电极反应式为:2Cl-→Cl2↑+2e- |
| B.阴极的电极反应式为:TiO2 + 4e-→Ti + 2O2- |
| C.通电后,O2-、Cl-均向阴极移动 |
| D.石墨电极的质量不发生变化 |
氢氧燃料电池是一种新能源。下图为氢氧燃料电池示意图。下列说法不正确的是
| A.该装置能将化学能转化为电能 |
| B.A极是正极,B极是负极 |
| C.电子由A极通过导线流向B极 |
| D.产物为无污染的水,属于环境友好电池。 |
已知离子可在琼脂中移动。某简易电池如图所示。放电时,下列说法错误的是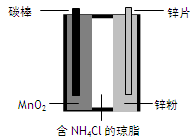
| A.锌极上电极反应式为:Zn-2e-= Zn2+ |
| B.MnO2得电子被还原 |
| C.NH4+ 离子通过琼脂向锌极移动 |
| D.外电路电流的方向从碳棒到锌片 |
Li-Al/FeS电池是一种正在开发的电动车用电池,该电池反应式为:
2Al+6Li++3FeS=2Al3++3Li2S+3Fe。有关该电池的下列说法中,正确的是
| A.作为二次电源,该电池在使用的过程中至少存在3种形式的能量转化 |
| B.Li-Al在电池中作为负极材料,负极的电极反应式为Li-e-=Li+ |
| C.该电池替代现在电动车广泛使用的铅蓄电池可以减少重金属的污染 |
| D.充电时,阴极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS |
某同学使用直流电源,在烧杯里电解饱和食盐水,电极用铁钉和碳棒。该同学错误地将铁钉接在电源正极,碳棒接负极.此情况下接通电源,观察到的现象可能是
| A.阳极和阴极上都产生了气泡 |
| B.阳极处产生了气泡,此气泡使湿润的碘化钾淀粉试纸变蓝 |
| C.溶液出现了灰绿色浑浊,后逐渐变成了红褐色 |
| D.阴极处未产生气泡,滴入酚酞试剂后变红 |
(1)燃料电池作为绿色能源得到迅速发展,二甲醚(CH3OCH3)质子交换膜燃料电池的电池反应为:CH3OCH3+3O2 2CO2+3H2O,制取二甲醚的反应如下:
2CO2+3H2O,制取二甲醚的反应如下:
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO(g)+2H2(g) CH3OH(g) △H=-90.7kJ·mol-1
CH3OH(g) △H=-90.7kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
①写出由CO和H2制取二甲醚和CO2的热化学方程式: 。
②二甲醚质子交换膜燃料电池是以酸性溶液为电解质溶液,二甲醚从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入O2的一极为 极,电极反应式为
(2)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
①工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_________________________________________________________
②生产中可用盐酸来除铁锈。现将 一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式____________________________________________________
一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式____________________________________________________
③下列哪个装置可防止铁棒被腐蚀_____________
④在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下,请回答:
A电极对应的金属是 (写元素名称),
B电极的电极反应式是 ________________