已知铅蓄电池的充放电过程:Pb(s)+PbO2(s)+2H2SO4(aq) 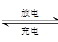 2PbSO4(s)+2H2O(l),则下列说法不正确的是( )
2PbSO4(s)+2H2O(l),则下列说法不正确的是( )
| A.放电时Pb为负极发生氧化反应生成PbSO4,负极质量减少 |
| B.放电时正极:PbO2+4H++2e-+ SO42-=PbSO4+2H2O,正极质量增加 |
| C.充电时蓄电池的负极接外电源负极:PbSO4(s) +2e- = Pb(s) + SO42- |
| D.充电时蓄电池的正极接外电源正极:PbSO4 (s)+2H2O -2e- = PbO2(s) + 4H++ SO42- |
下列说法不正确的是( )
| A.铅蓄电池在放电过程中,负极、正极质量都增加 |
B.常温下,反应 不能自发进行,则该反应的 不能自发进行,则该反应的 |
| C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
D.相同条件下,溶液中 、 、 、 、 的氧化性依次减弱 的氧化性依次减弱 |
纽扣式银锌电池的构造示意图如下图所示,
电池的总反应为:
下列说法不正确的是
A. 作负极 作负极 |
B.电子经外电路流向 极 极 |
C. 向 向 极移动 极移动 |
D.正极反应: |
燃料电池是燃料(如CO、H2、CH4等)跟O2(或空气)反应,将化学能转化为电能的装置。对于以强碱为电解质的CH4燃料电池,下列说法正确的是
| A.负极反应式为:O2+2H2O+4e=4OH- |
| B.负极反应式为:CH4+10OH--8e=CO32-+7H2O |
| C.随着放电的进行,溶液的pH不变 |
| D.放电时溶液中的阴离子向正极移动 |
在 500 g CuSO 4 溶液中插入两根电极,一极为铜,一极为粗铜(含锌)。通电电解至粗铜刚好全部溶解掉,这时铜极质量增加 7.04 g ,电解质溶液质量增加 0.02 g 。求粗铜中含锌的质量分数。
实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
今若制得Cl20.050mol,这时电池内消耗的H2SO4的物质的量至少是
| A.0.025mol | B.0.050mol | C.0.10mol | D.0.20mol |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e-+ H2O = CH3COOH + 4H+。下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH + O2 = CH3COOH + H2O |
| D.正极上发生的反应为:O2 + 4e-+ 2H2O = 4OH- |
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:Pb+ PbO2 + 2H2SO4 2PbSO4 + 2H2O根据此反应判断下列叙述中正确的是
2PbSO4 + 2H2O根据此反应判断下列叙述中正确的是
| A.放电时PbO2是电池的负极 |
| B.放电时,负极的电极反应式为:Pb+SO42--2e-=PbSO4 |
| C.放电时,溶液中的H+向正极区移动,正极区域的溶液的酸性增强 |
| D.充电时,该电池的正极接电源的负极 |
下列叙述不正确的是
| A.太阳能蓄电池只是将太阳能直接转化为电能的装置 |
| B.燃料电池是将化学能直接转化为电能的装置,所以能量利用率高 |
| C.碱性Zn-Mn干电池比酸性Zn-Mn干电池耐用,且不易漏液 |
| D.手机上用的锂离子电池属于二次电池 |
铅蓄电池的电池反应为 Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l),下列说法错误的是
2PbSO4(s)+2H2O(l),下列说法错误的是
| A.放电时电解质溶液的H+浓度逐渐减小 |
| B.利用铅蓄电池电解饱和食盐水制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少0.10 mol |
| C.充电时阴极的电极反应为 PbSO4(s) + 2e-="Pb(s)" + SO42-(aq) |
| D.放电时负极材料质量减小 |
如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是
| A.质子透过离子交换膜由右向左移动 |
| B.铜电极应与X相连接 |
| C.M电极反应式:(C6H10O5)n + 7nH2O-24ne-= 6nCO2↑+ 24nH+ |
| D.当N电极消耗0.25 mol气体时,则铁电极增重16 g |
电瓶车所用电池一般为铅蓄电池(如图),是一种的可充电电池,电池总反应式为:
Pb+PbO2+2H2 SO4 2Pb SO4+2H2O。则下列说法正确的是
2Pb SO4+2H2O。则下列说法正确的是
| A.放电时,负极板上发生了还原反应 |
| B.放电时,正极反应是:Pb-2e一+ SO42—=PbSO4 |
| C.充电时,铅蓄电池的负极应与充电器电源的正极相连 |
| D.充电时,阳极反应是:PbSO4-2e一+2H2O= PbO2+ SO42—+4H+ |
下列说法正确的是
| A.电池充电时其正极应与外电源的负极相连而成为阴极 |
| B.氢氧燃料电池(碱性介质)的正极反应式:O2 +4e- →2O2- |
| C.粗铜精炼时,与电源正极相连的是纯铜 |
| D.铁件上镀铜时,将铁件与电源的负极相连 |
以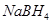 (B元素的化合价为+3)和
(B元素的化合价为+3)和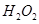 为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为
为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为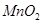 ,工作原理如图所示。下列说法不正确的是
,工作原理如图所示。下列说法不正确的是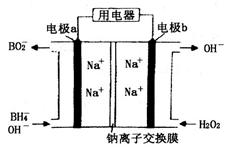
| A.该电池工作时Na+由a极区移向b极区 |
| B.电极b是原电池的正极 |
C.该电池的负极反应为: = = |
D.电路中通过6.02×1022个电子时,理论上消耗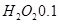 mol mol |