镁合金是重要的民用和航空材料,镁作为一种强还原剂,还用于钛、镀和铀的生产,氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等。
(1)氧化镁的电子式为________。
(2)写出镁与TiCl4在高温条件下制取钛的化学方程式____________________。
(3)从海水中提取金属镁用到的主要化学药品有________________。
(4)某研究小组同学在实验室用卣块制备少量Mg(ClO3)2·6H2O,其流程如下:
已知:I卤块主要成分为Mg Cl2·6H2O,含有MgSO4、FeCl2等杂质。Ⅱ可选用的试剂:H2O2,稀硫酸、KMnO4溶液、MgCl2溶液、MgO。
①加入BaCl2溶液的目的是____________。
②步骤X中需将Fe2+转化为Fe3+,所选的试剂为__________。
③Mg(ClO3)2加入到含有KSCN的FeSO4酸性溶液中立即出现红色,写出相关反应的离子方程式:________________________________________.
“探险队员”——盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
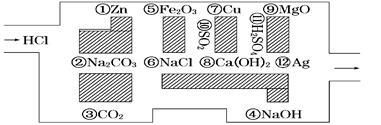
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)_____________。
(2)在不能“吃掉”盐酸的物质中,属于非电解质的是________(填写物质序号),在能“吃掉”盐酸的物质中,属于电解质的是 (填写物质序号)。
(3)如果将盐酸换成碳酸镁,它能沿着盐酸走出的路线“走出”这个迷宫吗?填“能”或“不能”_____,写出离子方程式说明其原因: 。
(4)写出氧化铝与④反应的化学方程式 ,氧化铝属于 ____________氧化物(填“酸性”“碱性”或“两性”)。
下表列出了A~M 13种元素在周期表中的位置:
| 1 |
A |
|
|
|
|
|
|
|
| 2 |
|
|
|
B |
C |
D |
E |
|
| 3 |
F |
G |
H |
|
|
I |
J |
K |
| 4 |
L |
M |
|
|
|
|
|
|
(1)这些元素中,金属性最强的元素是_______(填元素名称,下 同),非金属性最强的是__________,最不活泼的元素
同),非金属性最强的是__________,最不活泼的元素 是_________。
是_________。
(2)写出H元素的最高价氧化物对应的水合物分别与F元素的最高价氧化物对应的水合物、J元素氢化物的水溶液反应的离子方程式_________ ________、 。
(3)I2—、J-、L+、M2+等微粒中,半径最大的是________,最小的是__________。
(4)A与D形成的化合物A2D2是___________化合物,其电子式为_____________________。
下表中有九种物质,据表回答: (12分)
| |
第I 组 |
第II 组 |
第III 组 |
| 甲 |
BaCl2 |
Fe |
Cu(NO3)2 |
| 乙 |
Fe2O3 |
K2SO4 |
H2SO4 |
| 丙 |
Zn |
Ba(OH)2 |
MgCl2 |
(1) 第III 组中有一种物质能与第 组中的所有物质反应,这种物质是 .
(2) 不跟第I 组中所有物质反应且能与第III 组中所有物质反应的第II 组中的物质是 ,其与硫酸反应的离子方程式为 ;
甲、乙、丙三种物质之间有如下转化关系:
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是_____________写出乙 丙转化的化学方程式 :_______________________________ .
丙转化的化学方程式 :_______________________________ .
(2)若乙溶液中加入KSCN溶液 ,有血红色出现,则甲物质是_________________.
写出 甲 乙转化的离子方程式___________________________________.
乙转化的离子方程式___________________________________.
已知:氧化性:KMnO4>HNO3;Bi 元素+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进 行下列实验,现象记录如下。
行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)Bi和P元素在同一主族,试写出P在周期表中的位置 ;
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 ;
(3)实验④中的现象为: ;
(4)实验②反应的离子方程式是: ;
(5)实验③反应的离子方程式是:_ 。
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
其它性质 |
| SO2Cl2 |
-54.1 |
69.1 |
①易水解,产生大量白雾 ②易分解:SO2Cl2  SO2↑+Cl2↑ SO2↑+Cl2↑ |
| H2SO4 |
10.4 |
338 |
吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器A冷却水的进口为 (填“a”或“b”)。
(2)仪器B中盛放的药品是 。
(3)实验时,装置丁中发生反应的离子方程式为 。
(4)装置丙的作用为 ,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为 。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是 。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液): 。
现有盐酸、铁、氢气、碳酸氢钠、氢氧化钡。根据要求回答下列问题:
(1)下图为常见物质的树状分类图:
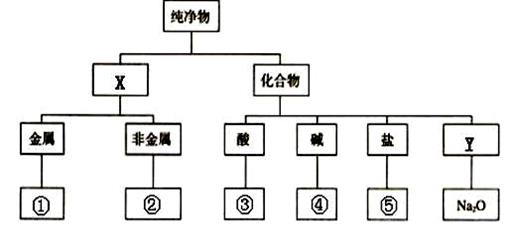
X属于_________(填物质类属);若图中①—⑤分别代表上述五种物质,则④对应的化学式是 。
(2)上述五种物质中,有一种物质能与其他三种物质发生反应。该物质是__________。
(3)上述五种物质间发生置换反应的离子方程式____________________
(4)写出过量的③与④反应的离子方程式 ____________________
(1)在BaCl2溶液中滴加Na2C2O4(草酸钠)溶液,产生白色沉淀。在白色沉淀中加入盐酸,沉淀溶解。
①试写出有关反应的离子方程式
②根据上述判断,可得出酸跟盐反应的一种规律是
(2)常温下,0.10 mol/L NH4Cl溶液pH______7(填>、=或<),溶液中各离子浓度由大到小的顺序是______________________________。
(3) Na2S溶液呈碱性的原因是________________________________(写出有关的离子方程式,下同),Al2(SO4)3溶液呈酸性的原因是_______________________________,普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是________________________。
A、B、C、D四种化合物的焰色反应均为黄色;C、D与盐酸生成一种无色无味气体E,该气体能使澄清石灰水变浑浊;D和A可反应生成C;B和E反应可生成C和另一种无色无味气体F。请回答下列问题:
(1)写出E、F的化学式:E ,F 。
(2)写出B和E反应的化学方程式: 。
(3)写出D和A反应的离子方程式: 。
某溶液X中含有H+、Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的几种(除此以外,无其他大量存在的离子),针对该溶液进行实验,内容如下:
①用洁净的玻璃棒蘸取少量X溶液,点在pH试纸上,试纸显红色;
②取适量X溶液,加入过量的Ba(NO3)2溶液,得澄清透明的溶液A,并放出一种无色无味的气体B;
③向溶液A中加入过量的NaOH溶液,微热,放出一种有刺激性气味的气体C,同时生成红褐色沉淀D,过滤得到溶液F;
④向F溶液中通入过量的CO2,有白色沉淀生成。
请回答:
(1)C、D的化学式分别为:C 、D 。
(2)步骤②中反应的离子方程式为: ;
步骤④中反应的离子方程式为: 。
(3)X溶液中一定含有的离子是: ,不能确定是否含有的离子是 ,
若要确定该离子(若不止一种,可任选一种)是否存在,可靠的化学方法是 。
(1)向硫酸氢钠溶液中,逐滴加入Ba(OH)2溶液至中性。请写出发生反应的化学方程式: ;
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式 ;