能正确表示下列反应的离子方程式是
| A.乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH-→ CH3COOH+ C2H5O- |
| B.用银氨溶液检验乙醛的醛基: CH3CHO +2Ag(NH3)2+ + 2OH- 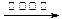 CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O |
C.向苯酚钠溶液中通入少量的CO2:CO2 + H2O + 2C6H5O- 2C6H5OH + 2CO32- 2C6H5OH + 2CO32- |
D.溴乙烷与氢氧化钠溶液反应:CH3CH2Br + OH - - 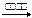 CH3CH2OH+ Br- CH3CH2OH+ Br- |
下列离子方程式,书写正确的是
| A.碳酸氢钠溶液中加入足量的澄清石灰水: 2HCO  + Ca2++ 2OH-=CaCO3↓+ CO + Ca2++ 2OH-=CaCO3↓+ CO +2H2O +2H2O |
| B.硝酸银溶液中加入铜粉 Ag++Cu===Cu2++Ag |
| C.氧化铜与盐酸反应 O2― +2H+==H2O |
D.碳酸镁跟稀硫酸反应:MgCO3+2H+ Mg2++H2O+CO2↑ Mg2++H2O+CO2↑ |
下列化学方程式或离子方程式中,书写正确的是
| A.氢氧化铜溶于醋酸溶液中:Cu(OH)2+2H+==Cu2++2H2O |
B.乙醛的银镜反应:CH3CHO+Ag(NH3)2OH CH3COONH4+NH3+Ag↓+H2O CH3COONH4+NH3+Ag↓+H2O |
C.苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O C6H5OH+HCO3- C6H5OH+HCO3- |
D.丙烯聚合: |
下列离子方程式正确的是
| A.向含0.2mol FeBr2的溶液中通入标准状况下的5.6L的Cl2: 5Cl2+4Fe2++6Br-==4Fe3++3Br2+10Cl- |
| B.次氯酸钙溶液中通入过量的二氧化硫气体ClO-+H2O+SO2==HSO-3+HClO |
| C.向硫酸亚铁溶液中通入H2S气体Fe2++H2S==FeS↓+2H+ |
| D.Cl2通入石灰乳中制取漂白粉Cl2+2OH-==Cl-+H2O+ClO- |
下列离子方程式不正确的是
A.足量乙酸与碳酸钠溶液反应:2CH3COOH + CO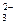 ="=" 2CH3COO-+CO2↑ +H2O ="=" 2CH3COO-+CO2↑ +H2O |
| B.醋酸溶液与氢氧化铜反应: 2CH3COOH + Cu(OH)2→Cu2+ + 2CH3COO-+ 2H2O |
| C.苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+ CO2 + H2O  2C6H5OH + CO 2C6H5OH + CO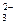 |
| D.甲醛溶液与足量的银氨溶液共热 |
HCHO+4[Ag(NH3)2]++4OH- CO
CO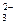 +2NH
+2NH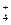 +4Ag↓+6NH3+2H2O
+4Ag↓+6NH3+2H2O
六价铬[Cr(Ⅵ)]有剧毒,废水中的Cr2O 常用铁氧磁体法除去,即把过量的FeSO4•7H2O加入含Cr2O
常用铁氧磁体法除去,即把过量的FeSO4•7H2O加入含Cr2O 的废水中,调节pH<4,Fe2+还原Cr(Ⅵ)为Cr3+。
的废水中,调节pH<4,Fe2+还原Cr(Ⅵ)为Cr3+。
(1)写出Fe2+还原Cr2O 的离子方程式,并标明电子转移的方向和数目:
的离子方程式,并标明电子转移的方向和数目:
_________________________________________________________。
(2)调节(1)得到溶液的pH值为8~10,将析出相当于Fe(Ⅱ)[Fe(Ⅲ)xCr2-x]O4(磁性材料铁氧体)的沉淀,由(1)可确定x=_______。
(3)Cr3+在过量的NaOH溶液中会转化为CrO ,写出这一转化的离子方程式_______________________________,由此可知Cr(
,写出这一转化的离子方程式_______________________________,由此可知Cr( OH)3呈_________(选填“酸”、“碱”或“两”)性。
OH)3呈_________(选填“酸”、“碱”或“两”)性。
已知,同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS >H2S >CuS,则以下离子方程式错误的是
| A.Mg2+ + 2 HCO3- + 2Ca2+ + 4 OH- → Mg(OH)2↓ + 2CaCO3↓ + 2H2O |
| B.Cu2+ + H2S → CuS↓ + 2H+ |
| C.Zn2+ + S2- + 2H2O → Zn(OH)2↓ + H2S↑ |
| D.FeS + 2H+ →Fe2+ + H2S↑ |
已知电离平衡常数:H2CO3>H ClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。
ClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。
下列有关离子反应或离子方程式的叙述中,正确的是( )
| A.能使PH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 |
| B.向溴水中加入足量氯化亚铁溶液能使溶液变成无色 |
| C.向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+ H2O |
| D.向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl- |
能正确表示下列反应的离子方程式为 ( )
| A.少量SO2通入苯酚钠溶液中(酸性:H2SO3>HSO3->苯酚):SO2+H2O+C6H5O-=C6H5OH+HSO3― |
| B.将Na2O2固体投入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑ |
| C.向溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br— + 2Cl2 ="=" Fe3+ + Br2 + 4Cl— |
| D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO完全沉淀: |
NH+Al3++2SO+2Ba2++4OH-= Al(OH)3↓+NH3·H2O+2BaSO4↓
下列热化学方程式或离子方程式中,正确的是:
| A.将金属钠加入水中:2Na + 2H2O = 2Na+ + 2 OH- + H2↑ |
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g)△H= -38.6kJ·mol-1 2NH3(g)△H= -38.6kJ·mol-1 |
| C.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H= -890.3kJ·mol-1 |
| D.氯化镁溶液与氨水反应:Mg2++2 OH-=Mg(OH)2 |
下列离子方程式正确的是
| A.FeSO4酸性溶液中加入H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O |
| B.4 mol的Cl2通入含3molFeBr2的溶液中: 2Fe2++6Br-+4Cl2=2Fe3++6Cl-+3Br2 |
| C.漂白粉溶液中通入SO2: Ca2++ 2ClO-+ SO2 + H2O =CaSO3↓+2HClO |
| D.NaHCO3水溶液里电离NaHCO3==Na+ + H+ + CO32- |
下列离子方程式与所述事实相符且正确的是( )
①将氯气溶于水制备次氯酸:Cl2+H2O===2H++Cl-+ClO-
②漂白粉溶液在空气中失效:ClO-+CO2+H2O===HClO+HCO3-
③向Na[Al(OH)4]溶液中通入过量CO2制Al(OH)3:[Al(OH)4]-+CO2===Al(OH)3↓+HCO3-
④将铁粉加入稀H2SO4中:2Fe+6H+===2Fe3++3H2↑
⑤用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-===Mn2++Cl2↑+2H2O
⑥用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2===2Mn2++5O2↑+8H2O
| A.③⑥ | B.⑤⑥ | C.①② | D.③ |
下列离子方程式书写正确的是
| A.向明矾溶液中加入过量的氢氧化钡溶液: Al3+ + 2SO42-+ 2 Ba2+ + 4OH-= AlO2- + 2BaSO4↓+ 2H2O |
| B.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+ = Fe2++2H2O |
| C.向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3?H2O |
| D.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热: |
CH2BrCOOH+OH- ="==" CH2BrCOO-+H2O
下列离子方程式正确的是
| A.NaHSO3溶液中投入过氧化钠粉末:4HSO3- +2Na2O2 ="=" 4SO32- + O2 ↑ + 4Na+ |
| B.明矾溶液与等物质的量的氢氧化钡溶液混合: 3Ba2+ +6OH— + 2Al3+ + 3SO42— ═ 3BaSO4↓+ 2Al(OH)3↓ |
| C.氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| D.将氯化亚铁溶液和稀硝酸混合: Fe2++ 4H++NO3-= Fe3++2H2O+NO↑ |
下列离子方程式与所述事实相符且正确的是( )
| A.磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O |
| B.Ca(HCO3)2溶液中加入少量NaOH溶液: Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O |
| C.明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多: Al3++2SO42-+2Ba2++4OH  -=AlO2-+2BaSO4↓+2H2O -=AlO2-+2BaSO4↓+2H2O |
D.向含有0.4 mol FeBr2的溶液中通入0.3  mol Cl2充分反应: mol Cl2充分反应: |
4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2