下列离子方程式书写正确的是
| A.金属铜与硝酸银溶液反应:Cu+Ag+=Cu2++Ag |
| B.稀硫酸与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
C.氯气与水反应:H2O+Cl2 2H++Cl-+ClO- 2H++Cl-+ClO- |
| D.氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O |
下列各物质转化关系如图所示,A是一种高熔点固体,D是一种红棕色固体。
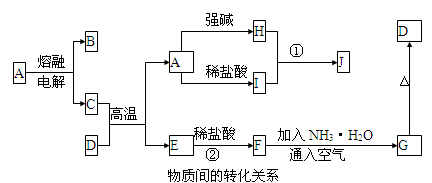
根据上述一系列关系回答:
(1)填写物质的化学式:B , G 。
(2)写出D物质中金属元素基态原子的核外电子排布图 。
(3)写出下列反应的离子方程式:
①H溶液和I溶液混合生成J___________ 。
②E和盐酸反应 。
(4)在电解熔融状态A的过程中,当电路中通过1mol电子时,阳极上产生的气体体积为 L。(标准状况下)
下列离子方程式正确的是
| A.铁屑溶于稀盐酸:2Fe+6H+=2Fe3++3H2↑ |
| B.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| C.Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| D.NaOH溶液中滴加少量Al2(SO4)3溶液:Al3++3OH-=Al(OH)3↓ |
三氯氢硅(
)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1) 在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成 等,写出该反应的化学方程式________。
(2) 在催化剂作用下发生反应:
则反应 的 ________ 。
(3)对于反应 ,采用大孔弱碱性阴离子交换树脂催化剂,在 和 时 的转化率随时间变化的结果如图所示。
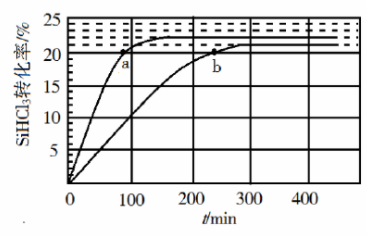
① 时反应的平衡转化率 α=________%。平衡常数 ________(保留2位小数)。
②在 下:要提高 转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小: ________ (填"大于""小于"或"等于")。反应速率 − , 、 分别为正、逆向反应速率常数, x为物质的量分数,计算a处 =________(保留1位小数)。
无机推断题组(一题多变题组)
已知:A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。

(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出E中含有的化学键类型 ;已知1molA与水反应放出283.5kJ的热量,试写出A与水反应的热化学反应方程式 ;
(2)若A 为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则单质A与H2O反应的离子方程式 。
(3)若A 为淡黄色粉末,回答下列问题:
①1molA与足量的H2O充分反应时,转移电子总数为 。
②若X为非金属单质,通常为黑色粉末,写出D的结构式 ;
(4)若A为氧化物,X是Fe,溶液D加入KSCN溶液变红。
①A与H2O反应的离子方程式 。
②请用离子方程式表示D盐的净水原理 。
下列离子方程式正确的是
| A.铜和稀硝酸的反应:Cu2++4H++2NO3-=Cu2++2NO2↑+2H2O |
| B.氯化铁腐蚀印刷电路板:Fe3++Cu = Fe2++Cu2+ |
| C.氯化铝溶液加入氨水:Al3++3OH-= Al(OH)3↓ |
D.实验室制氯气:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
以下是某学习小组对乙二酸的某些性质进行研究性学习的过程:
[研究课题]探究乙二酸的某些性质
[查阅资料]乙二酸(HOOC-COOH)俗称草酸,草酸晶体的化学式为H2C2O4·2H2O;草酸在100℃时开始升华,157℃时大量升华,并开始分解;草酸蒸气在低温下可冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
[提出猜想]
猜想一:乙二酸具有不稳定性
根据草酸晶体的组成,该小组同学猜想其受热分解产物为CO、CO2和H2O。 设计方案:
(1)请用下列装置组成一套探究并验证其产物的实验装置(草酸晶体分解装置略,连接导管略去)

请回答下列问题:
① 装置的连接顺序为:A→( )→D→( )→B→D;
② 实验时,在点燃B处酒精灯之前,应进行的操作是 。装置中碱石灰的作用是 。检验产物中有CO的实验现象 是 。
③ 整套装置存在不合理之处为 。
猜想二: 乙二酸具有还原性设计方案:
(2)该小组同学向酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色并产生一种气体,从而判断草酸具有较强的还原性。该反应的离子方程式为 。
硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO 2的催化氧化:SO 2(g) O 2(g) SO 3(g)△H=﹣98kJ•mol ﹣ 1.回答下列问题:
(1)钒催化剂参与反应的能量变化如图(a)所示,V 2O 5(s)与SO 2(g)反应生成VOSO 4(s)和V 2O 4(s)的热化学方程式为: 。
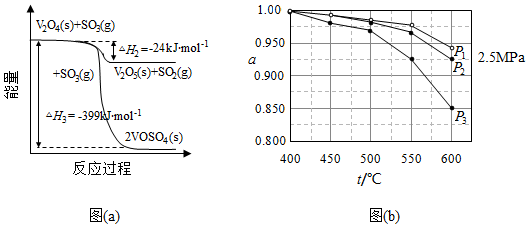
(2)当SO 2(g)、O 2(g)和N 2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO 2平衡转化率α随温度的变化如图(b)所示。反应在5.0MPa、550℃时的α= ,判断的依据是 。影响α的因素有 。
(3)将组成(物质的量分数)为2m% SO 2(g)、m% O 2(g)和q% N 2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO 2转化率为α,则SO 3压强为 ,平衡常数K p= (以分压表示,分压=总压×物质的量分数)。
(4)研究表明,SO 2催化氧化的反应速率方程为:v=k( 1) 0.8(1﹣nα′)式中:k为反应速率常数,随温度t升高而增大;α为SO 2平衡转化率,α′为某时刻SO 2转化率,n为常数。在α′=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图(c)所示。

曲线上v最大值所对应温度称为该α′下反应的最适宜温度t m.t<t m时,v逐渐提高;t>t m后,v逐渐下降。原因是 。
下列化学反应的离子方程式错误的是( )
| A.Al(OH)3与盐酸反应:Al(OH)3+3H+===Al3++3H2O |
| B.Al2O3溶于过量NaOH溶液:Al2O3+2OH-===2AlO+H2O |
| C.铁溶于稀H2SO4中:2Fe+6H+===2Fe3++3H2↑ |
| D.Al(OH)3溶于NaOH溶液:Al(OH)3+OH-===AlO+2H2O |
下列反应的离子方程式正确的是
A.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
| B.向盐酸中滴加氨水:H++OH﹣═H2O |
| C.金属钠与水反应:2Na + 2H2O=2Na+ +2OH- +H2↑ |
| D.用FeCl3溶液腐蚀印刷电路铜板:Fe3++ Cu= Fe2++ Cu2+ |
环戊二烯(  )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知: 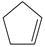 (g) =
(g) = 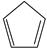 (g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
(g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
H 2(g)+ I 2(g) =2HI(g) Δ H 2=−11.0 kJ·mol −1 ②
对于反应:  (g)+ I 2(g) =
(g)+ I 2(g) = 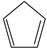 (g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯( 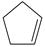 )在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
)在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
| A. |
通入惰性气体 |
B. |
提高温度 |
| C. |
增加环戊烯浓度 |
D. |
增加碘浓度 |
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
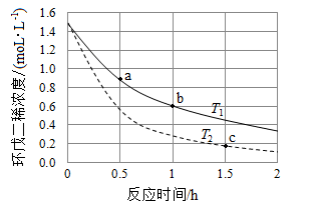
| A. |
T 1> T 2 |
| B. |
a点的反应速率小于c点的反应速率 |
| C. |
a点的正反应速率大于b点的逆反应速率 |
| D. |
b点时二聚体的浓度为0.45 mol·L −1 |
(4)环戊二烯可用于制备二茂铁(Fe(C 5H 5) 2结构简式为  ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
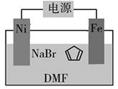

该电解池的阳极为________,总反应为________。电解制备需要在无水条件下进行,原因为________。
联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为________,其中氮的化合价为________.
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为________.
(3)①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=﹣1048.9kJ•mol﹣1
上述反应热效应之间的关系式为△H4=________,联氨和N2O4可作为火箭推进剂的主要原因为________.
(4) 联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为________(已知:N2H4+H+⇌N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为________.
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是________.联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是________.
某校学生课外活动小组为测定Na元素的相对原子质量,甲同学设计的装置如右图,该装置(包括仪器、水和干燥剂)的总质量为ag,从实验室取出b g的钠(不足量,不含煤油)放入水中,塞紧瓶塞,完全反应后再称量此装置的总质量为cg。试回答:

(1)该反应的离子方程式为 ;
(2)此干燥管的作用是 ;若此钠块有少量被氧化,则测出的相对原子质量会比实际相对原子质量 (填“偏大”、“偏小”或“不变”);
(3)乙同学认为此设计方案会使测定结果 (填“偏大”、“偏小”或“不变”),建议在图中干燥管上再连一个同样的干燥管且该干燥管不参与称质量,其目的是 ,计算钠的相对原子质量的表达式为____________;
(4)丙同学为避免由于行动不够迅速产生偏差,又建议在广口瓶中再加入一定量煤油,其目的是_ ___。
下列解释事实的离子方程式不正确的是
| A.Na放入水中,产生气体:2Na + 2H2O =2Na+ + 2OH-+ H2↑ |
| B.FeCl3溶液滴在淀粉碘化钾试纸上,试纸变蓝:2Fe3+ + 2I-= 2Fe2+ + I2 |
| C.铁溶于稀硝酸,溶液变黄:3Fe + 8H+ + 2NO3-= 3Fe2+ + 2NO↑+ 4H2O |
| D.Al片置于NaOH溶液中,产生气体:2Al + 2OH-+ 2H2O =2AlO2- + 3H2↑ |
下列表示对应化学反应的离子方程式正确的是
| A.Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ |
| B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C.次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
| D.将一定量的Al片投入足量的NaOH溶液中:2Al+2OH-+2H2O =2AlO2-+3H2↑ |