X、Y、Z、W是元素周期表前四周期中的四种常见元素,相关信息见下:
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为34 |
(1)Z位于元素周期表第__________周期第__________族,Y和Z的最高价氧化物对应的水化物的酸性较强的是_____________(写水化物的化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在_____________个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是_____________,键长较长的是__________;
(3)W的基态原子核外电子排布式是__________W2Y在空气中煅烧生成W2O化学方程式是__________。
A、B、C、D、E代表五种常见元素,它们的核电荷数依次增大。其中元素E的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍, B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物。请回答下列问题:
(1)E的基态原子价层电子排布式为_______________________________。
(2)AB2分子中,A的杂化类型为_______________________________。
(3)AB2形成的晶体的熔点________(填“大于”、“小于”或“无法判断”)CD形成的晶体的熔点,原因是_________________________。
(4)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为_______(用元素符号表示)。
(5)由C、D两元素形成的化合物组成的晶体中,阴、阳离子都具有或近似具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如图所示为C、D形成化合物的晶胞结构图以及晶胞的剖面图:
若a=5.6×10-8 cm,则该晶体的密度为________g·cm-3(精确到小数点后1位)。
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(KJ·mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1∶3、熔点为190 ℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为____________;E元素的最高价氧化物分子的立体构型是________________。F元素原子的核外电子排布式是_______________,G的高价离子与A的简单氢化物形成的配离子的化学式为________________。
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由________________。
(3)A、G形成某种化合物的晶胞结构如图所示。若阿伏加德罗常数为NA,该化合物晶体的密度为a g·cm-3,其晶胞的边长为________ cm。
(4)在1.01×105 Pa、T1 ℃时,气体摩尔体积为53.4 L·mol-1,实验测得Q的气态密度为5.00 g·L-1,则此时Q的组成为________________。
A、B、C、D、E、F、G七种短周期元素的原子序数依次增大,其中仅有一种稀有气体元素。A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大; B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y ),D形成的分子为单原子分子.回答问题:
(1)Y的电子式为___________;
(2)液态化合物Y与稀H2SO4酸化的K2Cr2O7溶液作用可产生一种无色助燃性气体及可溶性的Cr2(SO4)3,则该反应的离子方程式为___________;
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式___________;
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应.写出该反应的离子方程式___________,这两种盐均含有的化学键类型为___________;
(5)由A、B两元素形成的化合物W可作为火箭推进器中的强还原剂,已知一个W分子和一个Y分子中都含有18个电子,0.5mol液态W和足量液态Y反应,生成一种无色无味无毒的气体B2和液态X,并放出408.8KJ热量.写出该反应的热化学方程式为___________;
X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
| 元素代号 |
X |
Y |
Z |
M |
Q |
R |
| 原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
0.037 |
| 主要化合价 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
+1 |
(1)Z在周期表中的位置是_________________。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是___________(填离子符号)。
(3)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,则M的氧化物与强碱溶液反应的离子方程式是___________。
(4)Q和R按原子个数比1:1组成的化合物甲,是一种“绿色”氧化剂.
①甲中所含共价键类型是___________。
②空气阴极法电解制备甲的装置如图所示.在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液.图中直流电源的a是_____极,阴极的电极反应式是___________。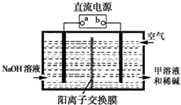
随原子序数的递增,八种短周期元素(用字母X等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)z在元素周期表的位置是 。
(2)比较d、f简单离子的半径大小(用化学符号表示,下同) > ;
比较d、g元素的简单气态氢化物的稳定性大小 > 。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式 。
(4)已知1mol固体e的单质在足量d2气体中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式 。
(5)由上述元素组成的离子化合物 Q:eh 和 W:e2gd4,若电解含2 molQ和2 molW的混合水溶液,当阳极产生44.8L气体(标准状况下,且不考虑气体的溶解和损失)时,电路中转移电子的物质的量为 mol。
(6)上述元素可组成盐R:zx4f(gd4)2。向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:

①R溶液中,离子浓度由大到小的顺序是 。
②写出m点发生反应的离子方程式 。
③若在R溶液中改加20mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为 mol。
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-半径,Y的氧化物是形成酸雨的主要物质之一。
请回答:
(1)Q元素在周期表中的位置
(2)将这五种元素原子半径从大到小排列,排在第三的元素原子是 (填元素符号)
(3)元素的非金属性Z Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有 (填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4) X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式 ;B的水溶液不呈中性的原因 (用离子方程式表示)
(5) 液态A类似X2Z能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为
(6)若使A按下列途径完全转化为F:

①F的化学式为 ;
②参加反应的A与完全转化为F时整个过程中消耗D的物质的量之比为
A、B、C、D、E是短周期中原子序数依次增大的主族元素,其中元素A的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。常温常压下,E单质是淡黄色固体,常在火山口附近沉积。
(1)CA与水反应放出气体的化学方程式为 。
(2)B 元素的元素符号: ;CA的电子式为 ;
D在元素周期表中的位置为 。
(3)A2E的燃烧热ΔH= -a kJ·mol-1,写出A2E燃烧反应的热化学方程式: 。
(4)甲、乙、丙分别是B、D、E三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同。回答问题:
① 向丙溶液中缓慢滴加过量的乙溶液过程中发生反应的离子方程式 , 。
② 向甲溶液中缓慢滴加等物质的量的丙溶液后,所得溶液中离子浓度由大到小的顺序为 。
(5)用D单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式: ;由R生成Q的化学方程式: 。
已知X、Y是两种性质相似的短周期元素。
Ⅰ.若X、Y是相邻相似 ,它们的单质都必须采用电解法制备,但都无需密封保存,
,它们的单质都必须采用电解法制备,但都无需密封保存,
(1)X离子的结构示意图_____________。(2)Y元素在周期表中位置__________。
Ⅱ.若X、Y是同族相似 ,X是形成化合物种类最多的元素。
,X是形成化合物种类最多的元素。
(3)I2O3以氧化XO,常用于测定XO含量,已知:①2I2(s)+5O2(g)=2I2O5(s)△H=-75.66kJ·mol-1
②2XO(g)+O2(g)=2XO2(g) △H=-566.0kJ·mol-1。请写出XO(g)与I2O5(s)和XO2(g)的热化学方程式:______。
(4)工业上用X单质与Y的氧化物反应制取Y单质的过程中,YO是反应中间产物,隔绝空气时YO和NaOH溶液反应(产物之一是Na2YO3)的离子方程式是_________________________。
Ⅲ.若X、Y是对角相似 ,X、Y的最高价含氧酸的浓溶液都有强氧化性。
,X、Y的最高价含氧酸的浓溶液都有强氧化性。
(5)下列试剂都可以证明X、Y的最高价含氧酸的浓溶液都有强氧化性的是_________。
| A.铁片 | B.铜片 | C.二氧化硫 | D.木炭 |
(6)HA是含有X元素的一元酸,常温下,将0.2mol/L的HA溶液与等体积、等浓度的NaOH溶液混合,所得溶液(假设溶液体积可以相加)中部分微粒组成及浓度如右图所示,图中N表示______(填微粒符号)。
(7)某化工厂设计要求:空气中YO2含量不得超过0.02mg/L。某同学用右图所示简易装置测定空气中的YO2含量:准确移取10mL5×10-4mol/L的标准碘水溶液,注入试管中,加2-3滴淀粉指示剂,此时溶液呈蓝色,在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,假设该同学的测量是准确的,则他抽气的次数至少为_______次时方可说明该厂空气中的YO2含量达标。
现有原子序数依次增大的W、T、X、Y、Z、R六种前四周期元素.TW3能使湿润的红色石蕊试纸变蓝色.X、Y位于同一主族且Y的原子序数是X的2倍.Z、R是生活中常见金属,Z、R的器皿在潮湿空气中分别生成红褐色锈和绿色锈.
请回答下列问题:
(1)TW3的电子式为 .
(2)由W、T、X、Y中的元索组成一种离子化合物M,能发生如图转化关系:
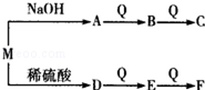
F与E的相对分子质量之差为16.则M的化学式可能为 .
C与水反应的化学方程式为 .
(3)(TW4)2Y2X8能和ZYX4在水溶液中反应生成Z2+和YX42﹣,写出离子方程式 .
(4)常温下,在WTX3浓溶液中以Z、R为电板构成原电池,负极材料是 ,
正极反应式为 .
现有部分短周期元素对应单质的性质或原子结构如下表所示:
| 元素编号 |
元素性质或原子结构 |
| X |
第三周期元素的简单离子中半径最小 |
| Y |
其最简单氢化物丙的水溶液呈碱性 |
| Z |
原子核外电子数和周期序数相等 |
A、B、C三种单质(分别有X、Y、Z元素组成)和甲、乙、丙、丁、戊五种化合物之间的转化关系如下图所示(某些条件已略去)。其中丁是一种高能燃料,一个分子含有18个电子,其组成元素与丙相同。

请回答:
(1)元素X在周期表中的位置是_______________,其简单离子的结构示意图为___________。
(2)单质B的电子式__________________。
(3)丙中所含的化学键类型有_________________________(填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:______________。
(5)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。该化学方程式为______________________。
短周期主族元素X、Y、Z、M、N,且原子序数依次增大,已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4且M原子的质子数是Y原子的2倍,N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,据此回答下列问题
(1)写出Z与N形成化合物的电子式____ _。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式__ __(分解反应)。
(3)下图表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:___ _ _。

(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1:1:1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为____,B的化学式为_______。A、B之间反应的离子方程式为 。A中存在的化学键类型为: 。
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) 。
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A B(在水溶液中进行)
B(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;
由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。A、B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
已知A、B、C、D四种元素分别为短周期元素,表示中三个不同短周期的主族元素,且原子序数依次增
大。D原子的质子数是B原子质子数的2倍,A原子与D原子的最外层电子数之和是B原子与C原子质子
数之和的1/3。A与B可形成BA3型化合物,该化合物与C的单质在一定条件下反应,能生成化合物BC,请按要求填写下列空白:
(1)D元素的名称 ,C元素在元素周期表中的位置 。
(2)写出BA3的电子式 ,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式 。
(3)D单质在工业上最重要的用途是 ,写出工业上制取D单质的化学方程式 。
(4)在实验室中B的最高价氧化物的水化物的浓溶液应如何保存 ,用化学方程
式说明理由 。
(I)A、B、C、D、E为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在C中充分燃烧能生成其最高价化合物BC2。D+与C2-具有相同的电子数。A在E中燃烧,产物溶于水得到一种强酸。回答下列问题:(1)B在元素周期表中的位置是 ,写出一种工业制备单质E方法的离子方程式 。(2)这五种元素两两之间能形成多种化合物,请写出A2C和DA相互反应的化学方程式
(II)化合物甲由四种元素组成,撞击甲容易发生爆炸生成三种物质,产物之一是纯净固体单质乙,另两种产物丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一,3.0g甲发生爆炸反应,生成2.16g乙和标准状况下0.224L丁,其余为丙.回答下列问题:
(1)丁的结构式
(2)甲发生爆炸反应的化学方程式为
(3)已知化合物甲中,有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,
爆炸反应中氧化产物与还原产物的物质的量之比为 .