已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。F原子核外最外层电子数与Na相同,其余各层电子均充满。
(1)E3+的价电子排布式为 。
(2)AB32— 的立体构型是 ,其中A原子的杂化轨道类型是 。
(3)A22— 与B22+ 互为等电子体,B22+的电子式可表示为 ___________,1mol B22+ 中含有的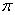 键数目为 。
键数目为 。
(4化合物DC2的晶胞结构如右图所示,形成的离子化合物的电子式为__________该离子化合物晶体的密度为a g/cm3,则晶胞的体积是 ____ cm3(只要求列算式,阿伏加德罗常数的值为NA)。
铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.
(1)基态Fe3+的M层电子排布式为 ;
(2)尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
(3)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= . Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型).
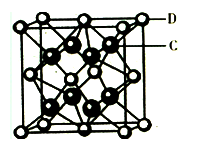
(4)常温条件下,铁的晶体采用如图所示的堆积方式.则这种堆积模型的配位数为 ,如果铁的原子半径为a cm,阿伏加德常数的值为NA,则此种铁单质的密度表达式为 g/cm3.

氮元素在自然界中存在多种价态,结合题干回答下列问题:
23.氮元素原子核外有 个未成对电子,最外层有 种能量不同的电子。
24.氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是 (填编号)。
a.NH3比PH3稳定性强
b.氮气与氢气能直接化合,磷与氢气很难直接化合
c.硝酸显强氧化性,磷酸不显强氧化性
d.氮气常温是气体,磷单质是固体
25.已知,氯胺NH2Cl熔点-66℃,NH4Cl熔点340℃,氯胺的电子式为 ,从物质结构的角度解释两者熔点相差较大的原因 。
26.NH2Cl比HClO稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂,NH2Cl发生水解的化学方程式为 。
27.工业上利用铝粉除去含氮废水中的NO3-,当控制溶液pH在10.7左右时,反应过程中生成AlO2-、氮气和氨气,若氮气和氨气的体积比为4:1,则还原剂和氧化剂的物质的量之比为 ,若氮气和氨气的体积比为1:1,则除去0.1mol NO3-,消耗铝______g。
Ⅰ.硼元素B在化学中有很重要的地位。硼的化合物在农业、医药、玻璃工业等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布简式 。从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为 。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料。同数原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是 。
(3)在BF3分子中中心原子的杂化轨道类型是 ,SiF4微粒的空间构型是 。又知若有d轨道参与杂化,能大大提高中心原子成键能力,试解释为什么BF3、SiF4水解的产物中,除了相应的酸外,前者生成BF4-,后者却是生成SiF62-: 。
Ⅱ.图所示为血红蛋白和肌红蛋白的活性部分---血红素的结构:

回答下列问题:
(1)根据元素电负性请判断H2N-CHO中碳和氮的化合价分别为 和 。
(2)血红素中两种氮原子的杂化方式分别为 , ;在图乙的方框内用“→”标出亚铁离子的配位键。
【化学——选修3:物质结构与性质】
E、G、M、Q、T是五种原子序数依次增大的前四周期元素。E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)与T同区、同周期元素原子价电子排布式是 。
(2)E、G、M均可与氢元素形成氢化物,它们的最简单氢化物在固态时都形成分子晶体,其中晶胞结构与干冰不一样的是 (填分子式)。
(3)E、G、M的最简单氢化物中,键角由大到小的顺序为 (用分子式表示),其中G的最简单氢化物的VSEPR模型名称为 ,M的最简单氢化物的分子立体构型名称为 。
(4)EM、GM+、G2互为等电子体,EM的结构式为(若有配位键,请用“→”表示) 。E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因 。
(5)TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如下图所示,该晶体的密度为ρ g·cm-3。如果TQ的摩尔质量为M g/mol,阿伏加德罗常数为NA mol-1,则a、b之间的距离为 cm。
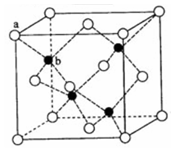
V、W、X、Y、Z是由四种短周期元素中的两种或三种组成的5种化合物,其中W、X、Z均由两种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素和两种非金属元素组成,其原子个数比为1︰3︰9,所含原子总数等于其组成中金属元素的原子序数。它们之间的反应关系如下图:
(1)写出W物质的一种用途 。
(2)写出V与足量NaOH溶液反应的化学方程式 。
(3)将过量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为 。
(4)4 g Z完全燃烧生成X和液态水放出222.5 kJ的热量,请写出表示Z燃烧热的热化学方程式 。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48 L X气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是 。
(6)Y是一种难溶物质,其溶度积常数为1.25×10-33。将0.01 mol Y投入1 L某浓度的盐酸中,为使Y完全溶解得到澄清透明溶液,则盐酸的浓度至少应为 (体积变化忽略不计,结果保留三位有效数字)。
已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)
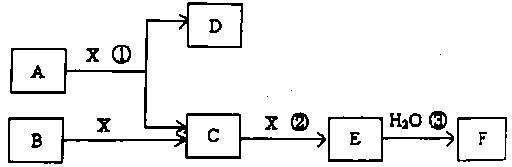
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式: 。
②A的分子结构模型为 。
③已知常温下46g气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方程式 。
④在常温下,向V1LpH=a的A溶液中加入V2LpH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填 无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物H,H的Ksp=8.1×10—9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其Ksp ,(填:增大、减小或不变),此时,组成不溶物H的阴离子在溶液中的浓度为 mol/L。
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)

(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则物质C中所含化学键类型为 ,写出反应④的化学方程式 .
(2)若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 ,检验E物质中阳离子的操作和现象 ,A单质与1mol/L稀硝酸160mL恰好反应,最多消耗A单质 g.
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为 ,写出D单质的一种用途 .
X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料.用化学用语回答下列问题:
(1)M的离子结构示意图 ;L在元素周期表中的位置为 .
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是 .
(3)Y的最高价氧化物的电子式为 .原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 .
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为 .
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与X形成化合物甲,1mol甲含18mol电子,请写出甲的结构式 .
(6)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为 .该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为 L.
已知A、B、C、D为第三周期元素,其原子的第一至第四电离能如下表所示:(单位:kJ/mol),回答下面各题:
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| A |
2080 |
4000 |
6100 |
9400 |
| B |
500 |
4600 |
6900 |
9500 |
| C |
740 |
1500 |
7700 |
10500 |
| D |
580 |
1800 |
2700 |
11600 |
(1)A是 B是 C是 D是 (填元素符号)
(2)B通常显 价,B的电负性 C的电负性(填“>”、“<”或“=”)。
(3)元素C的第一电离能比D高的原因是___________________________
(4)下列元素中,化学性质和物理性质最像A元素的是 。
A.氦(1s2) B. 铍(1s22s2) C. 锂(1s22s1) D. 氢(1s1)
(5)每种元素都出现相邻两个电离能的数据相差较大的情况,请你估计B的第2次电离能飞跃数据将是第___电子。
下表是元素周期表的一部分,针对表中元素,填写下列空白
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
| 三 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
(1)比HCl、H2S更稳定的氢化物是:__________________
(2)P、N、Mg原子半径由小到大的顺序是:_____________________
(3)Cl—的离子结构示意图是:________________________
(4)最高价氧化物对应水化物酸性最强的是:____________ (填名称)。:
(5)形成化合物种类最多的元素是:____________
(6)Si的最高价氧化物对应的水化物的化学式为:__________________
(7)Na与CuSO4溶液反应的化学方程式为(分步写): ;
。
运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如下图所示。

元素R在周期表中的位置是________________________。
元素Y和W形成的Y2W2型化合物中含有化学键的类型为_____________。
测定Z元素最高价氧化物对应水化物溶液物质的量浓度的方法为______________。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等。
下列能说明碳、硫两种元素非金属性相对强弱的是____________(填序号)
A.相同条件下水溶液的PH:Na2CO3>Na2SO4
B.酸性:H2SO3 >H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫的危害,其分子结构和CO2相似。
①羰基硫(COS)的电子式为:______________。
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:

已知A是一种正盐,则A的化学式为______________;若气体a为单质,反应II的离子方程式为________________________________________________。
X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。

①分别通入YX2和W2,在装置A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为 ;若装置D中装的是五氧化二钒,当通入足量YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
A 氨水 B 稀盐酸 C 稀硝酸 D 氯化钙 E 双氧水 F 硝酸银
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能的大小顺序是 (填元素符号),e的价层电子轨道示意图为 。
(2)c的氢化物与d的氢化物的沸点大小顺序是 ;(填化学式)原因是
(3)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;以上元素形成的分子中既含有极性共价键,又含有非极性共价键的化合物是 、 (填化学式,写出两种)。
(4)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸 ;(填化学式)酸根呈三角锥结构的酸是 。(填化学式)
(5) e和c形成的一种离子化合物的晶体晶胞结构如图1,则e离子的电荷为 ;其中c离子的配位数是 ;若已知该晶胞的边长为a pm,阿伏伽德罗常数为NA,则该晶胞的密度为 g/cm3.

已知X、Y、Z、Q为短周期非金属元素,R是长周期元素,X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)X元素为 ,X、Y、Z中第一电离能最大的是 。
(2)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):


该分子中Y原子的杂化方式是 。
(3)X与Y元素可以形成一种超硬新材料,其晶体部分结构如下图所示,有关该晶体的说法正确的是 (填写字母序号)。

| A.该晶体属于分子晶体 | B.此晶体的硬度比金刚石还大 |
| C.晶体的化学式是X3Y4 | D.晶体熔化时破坏共价键 |
(4)有一种AB型分子与Y单质分子互为等电子体,它是一种常用的还原剂,其化学式为 。
(5)R的基态原子的电子排布式为 ,R与Z形成的某离子晶体的晶胞结构如下图,则该晶体的化学式为 ,该晶体的密度为a g·cm-3,则晶胞的体积是 cm3(用含a、NA的代数式表示)。
